Nieuwe publicaties
AI detecteert prostaatkanker in een vroeg stadium, die door pathologen over het hoofd wordt gezien
Laatst beoordeeld: 23.08.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
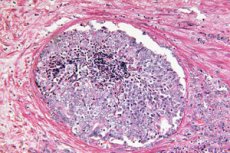
Scientific Reports toont aan dat kunstmatige intelligentie verborgen morfologische aanwijzingen voor een tumor in prostaatbiopsieën kan herkennen die voorheen door een patholoog als goedaardig werden beschouwd. Een deep learning-model, getraind met behulp van de zwak gesuperviseerde benadering, voorspelde welke mannen met een verhoogd PSA-gehalte in de komende 30 maanden klinisch significante prostaatkanker (ISUP > 1) zouden ontwikkelen en welke minstens 8 jaar kankervrij zouden blijven. Dit opent de deur naar vroege risicostratificatie direct na een eerste "schone" biopsie en kan helpen bepalen wie daadwerkelijk herhaalde invasieve procedures en intensievere surveillance nodig heeft.
Achtergrond van de studie
Een primaire naaldbiopsie van de prostaat levert vaak vals-negatieve resultaten op: een aanzienlijk deel van de klinisch significante kanker blijft "off-screen", vooral bij traditionele systematische TRUS-biopsie. De introductie van MRI-richtlijnen heeft het aantal klinisch significante kankerdetecties vergroot en het aantal onnodige herhalingen verminderd, maar zelfs met moderne strategieën blijven sommige agressieve tumoren onopgemerkt. Het klinische dilemma blijft hetzelfde: wie moet er na een "schone" biopsie worden geobserveerd en wie moet er worden doorverwezen voor een vroege herhalingsbiopsie, om de diagnose niet te vertragen en patiënten niet te overbelasten met invasieve ingrepen.
De biologische basis voor de oplossing van dit probleem is het TINT-fenomeen (tumor-instructed/indicating normal tissue): een tumor 'herconfigureert' de omliggende, ogenschijnlijk normale weefsels van het orgaan en laat daarin zwakke maar systematische sporen achter - van stroma-remodellering en hypoxie tot metabole verschuivingen. Deze veranderingen zijn beschreven in experimentele modellen en bij patiënten met prostaatkanker en correleren met de agressiviteit van de tumor, waardoor 'normaal' weefsel een potentiële bron van diagnostische signalen is, zelfs als er geen duidelijke kankerklieren in de biopsiekern aanwezig zijn.
Digitale pathologie en deep learning-methoden zijn gericht op het extraheren van dergelijke "subtiele" veldkenmerken uit standaard H&E-coupes. In tegenstelling tot klassieke morfologie, die zich richt op duidelijke tumorstructuren, kunnen algoritmen verspreide patronen in het stroma en epitheel vastleggen die verband houden met de aanwezigheid van een tumor in een ander deel van het orgaan. Dit opent de weg naar risicostratificatie direct na een negatieve biopsie: een hoge glasscore suggereert de wenselijkheid van een vroege herhalingsbiopsie of MRI-geleiding, een lage score ondersteunt een voorzichtigere observatie.
Dit is het idee achter een nieuwe studie in Scientific Reports: de auteurs testten of AI klinisch significante prostaatkanker in de komende 30 maanden kan voorspellen op basis van morfologische signalen uit TINT-biopsieën. Het werk bouwt voort op een eerder gepresenteerde pre-print en vormt een toegepaste basis voor de implementatie van digitale biomarkers in het veld na een eerste "schone" biopsie.
Hoe het is gedaan: ontwerp, data, algoritme
De auteurs verzamelden retrospectief een cohort van 232 mannen met een verhoogd PSA en een initiële conclusie van "benigne" op basis van een naaldbiopsie (na technische controle werden 213 patiënten en 587 coupes opgenomen in de uiteindelijke analyse; biopsieën 1997-2016, Umea, Zweden). Elke patiënt werd gekoppeld aan een "spiegelpaar" op basis van leeftijd, jaar van diagnose en PSA-niveau: de helft kreeg later de diagnose prostaatkanker (≤ 30 maanden), de andere helft bleef minstens 8 jaar kankervrij. Hepatitis C-preparaten werden gedigitaliseerd (20×), gesneden in 256×256 pixeltegels en gevoed met CLAM (Clustering-constrained Attention Multiple-Instance Learning) - een modern, zwak gesuperviseerd systeem, waarbij alleen het lot van de patiënt bekend is, en niet de markering van elke pixel. Kenmerken werden geëxtraheerd door ResNet18, vooraf getraind op 57 histopathologiedatasets. Het eindpunt is binair: laag risico (goedaardig/ISUP1) versus hoog risico (ISUP2-5).
Voorspellingsnauwkeurigheid
In een onafhankelijke test bereikte het model een AUC van 0,81 voor alle objectglaasjes en een AUC van 0,82 op patiëntniveau. Bij een drempelwaarde die een acceptabele balans bood, bedroeg de gevoeligheid 0,92 met een percentage vals-positieve uitslagen van 0,32 (op patiëntniveau). Met andere woorden, onder mensen bij wie de eerste biopsie "misliep", markeerde de AI correct de overgrote meerderheid van degenen bij wie al snel klinisch significante kanker werd vastgesteld, zij het ten koste van enkele valse alarmen. Voor de kliniek is dit een signaal: "goedaardige" biopsierespons ≠ nul risico, en dit kan kwantitatief worden gestratificeerd met behulp van een digitale bril.
Wat merkt AI precies op in ‘normaal’ weefsel?
Uit interpretatie via UMAP en aandachtskaarten bleek dat veranderingen in het stroma het meest informatief zijn:
- Meer collageen in het stroma (matrixcompactie, “fibrose”);
- Minder gladde spiercellen rond de klieren;
- Minder vaak voorkomend zijn subtiele signalen in het klierepitheel, waarschijnlijk onder de beschikbare downsamplingresolutie.
Dit patroon past binnen het TINT-concept (tumor-instructed/indicating normal tissue): zelfs de 'norm' in een orgaan waar een tumor verborgen zit, wordt onder invloed daarvan opnieuw geconfigureerd en verschilt van de 'norm' in een orgaan zonder tumor. Kanker is niet alleen een infectiehaard, maar ook een veld, en AI leert het veldeffect te interpreteren.
Hoe de aanpak in de praktijk nuttig is - mogelijke scenario's
- Risicogebaseerde re-biopsie: hoog AI-percentage op "schoon" glas - argument vóór vroege re-biopsie of MRI-begeleiding in plaats van wachten.
- Personalisatie van de monitoring: een lage snelheid compenseert de angst na een ‘grensgeval’-MRI en maakt het mogelijk de intensiteit van de monitoring te matigen.
- TINT-patroontraining: aandachtskaarten en interactieve overlays helpen pathologen subtiele velden rondom kanker te zien, waardoor de consistentie van rapporten wordt verbeterd.
Het is belangrijk om de beperkingen te begrijpen
Het betreft één centrum in Noord-Zweden (voornamelijk blanke bevolking), het ontwerp is retrospectief, de basisbiopsieën werden uitgevoerd zonder MRI-geleiding (systematische TRUS-biopsieën) en de markers zijn toekomstige uitkomsten in plaats van "occulte tumor op hetzelfde preparaat". Er is nog geen externe validatie bij onafhankelijke centra/scanners, noch is er een prospectief onderzoek naar het effect van het algoritme op klinische beslissingen en uitkomsten. Het percentage vals-positieve resultaten blijft significant: het model vervangt de arts niet, maar voegt een probabilistische laag toe voor gedeelde besluitvorming.
Wat volgt: implementatie-routekaart
- Multicenter externe validatie (verschillende scanners, protocollen, etnische groepen).
- Prospectieve beslissingsstudies: verandert de AI-score het traject van de patiënt (tijd tot diagnose, aantal onnodige herhaalde biopsieën, over-/onderdiagnose)?
- Integratie met MRI en kliniek: gecombineerde modellen (PSA, MRI PIRADS, klinische factoren + TINT-score volgens H&E).
- Technische stappen: standaardisatie van digitalisering, beheersing van datadrift, uitlegbaarheid (aandachtsoverlays voor routine).
Bron: Chelebian E., Avenel C., Järemo H., Andersson P., Bergh A., Wählby C., et al. Ontdekking van tumoren die morfologische veranderingen in goedaardige prostaatbiopsieën aangeven door middel van kunstmatige inseminatie. Scientific Reports (Nature Portfolio), gepubliceerd op 21 augustus 2025. DOI: https://doi.org/10.1038/s41598-025-15105-6
