Nieuwe publicaties
Geneesmiddel LM11A-31 vertraagt de progressie van de ziekte van Alzheimer in een studie
Laatst beoordeeld: 02.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.

In een recent onderzoek gepubliceerd in het tijdschrift Nature Medicine voerden wetenschappers een gerandomiseerde, dubbelblinde, placebogecontroleerde fase 2a-studie uit om de veiligheid en werkzaamheid van LM11A-31 te onderzoeken bij de behandeling van de ziekte van Alzheimer (AD) door modulatie van de p75-neurotrofine-receptor (p75NTR).
AD met late aanvang is de meest voorkomende vorm van dementie, gekenmerkt door synaptisch falen, degeneratie en verlies van zenuwcellen. Hoewel de twee belangrijkste geneesmiddelen voor de behandeling van AD zich richten op de ophoping van abnormale amyloïde-β- of tau-eiwitten, pakken ze slechts een deel van de pathofysiologie aan. Een andere aanpak richt zich op receptoren en signaalnetwerken die fundamentele biologische processen beïnvloeden. Preklinische studies tonen aan dat modulatie van p75NTR met een nieuw klein chemisch molecuul, LM11A-31, synaptisch verlies veroorzaakt door amyloïde en abnormaal tau vermindert.
Beschrijving van de studie
In deze gerandomiseerde klinische proef onderzochten de onderzoekers of LM11A-31 de progressie van de ziekte van Alzheimer kon vertragen door p75NTR bij mensen te moduleren.
Deelnemers aan het onderzoek kregen 242 patiënten met lichte tot matige astma gedurende 26 weken orale capsules met LM11A-31 in doses van 200 mg en 400 mg of placebo in een verhouding van 1:1:1. Deelnemers hadden een biologisch bevestigde vorm van de ziekte van Alzheimer (cerebrospinaalvocht amyloïde β-proteïne 42 (Aβ42) lager dan 550 ng/l of een Aβ42:β40-ratio lager dan 0,89), gediagnosticeerd volgens de McKhann-criteria, met een Mini-Psychiatric Examination (MMSE)-score van 18 tot 26, een Geriatric Depression Scale (GDS)-score lager dan 5,0, een Modified Hachinski Ischemic Scale (HIS)-score ≤ 4,0, een formele opleiding ≥ 8 jaar en een eerdere cognitieve achteruitgang ≥ 6 maanden.
Deelnemers die in aanmerking kwamen, hadden acetylcholinesteraseremmers (AChEI's) of partiële NMDA-receptorantagonisten gebruikt gedurende ≥ 3 maanden voorafgaand aan deelname aan het onderzoek. Ze gebruikten geen illegale drugs zoals antipsychotica, benzodiazepinen, anti-epileptica, kalmeringsmiddelen, centraal werkende antihypertensiva, nootropica (behalve ginkgo biloba) of opioïdenbevattende pijnstillers.
De primaire uitkomstmaat van de studie was veiligheid en verdraagbaarheid, beoordeeld met de Columbia Suicidal Thoughts and Behavior Severity Rating Scale (C-SSRS), vitale functies, bloeddruk en hematologische parameters. Structurele magnetische resonantiebeeldvorming (cMRI), fluorodeoxyglucose positronemissietomografie (FDG-PET) en biomarkers van cerebrospinaal vocht (CSF) werden gebruikt om secundaire cognitieve uitkomsten te beoordelen. De AD-metingen omvatten Thr181-gefosforyleerd tau, totaal tau-eiwit, Aβ40, Aβ42 en AChE-activiteit. Het team gebruikte een aangepaste neuropsychologische test om secundaire cognitieve uitkomsten te beoordelen bij aanvang, in week 12 en 26.
Onderzoeksresultaten
Uit de studie bleek dat LM11A-31 veilig en goed verdragen werd, zonder significante veiligheidsrisico's. De meest voorkomende bijwerkingen waren hoofdpijn, diarree, eosinofilie en nasofaryngitis, waarbij gastro-intestinale problemen en eosinofilie de belangrijkste redenen voor stopzetting waren. Er waren meer stopzettingen in de 400 mg-groep vergeleken met de 200 mg- en placebogroepen. MRI bracht geen veiligheidsrisico's aan het licht, waaronder amyloïde-gerelateerde afwijkingen. Er waren geen significante verschillen in cognitieve scores of amyloïde-afwijkingen tussen de twee behandelgroepen.
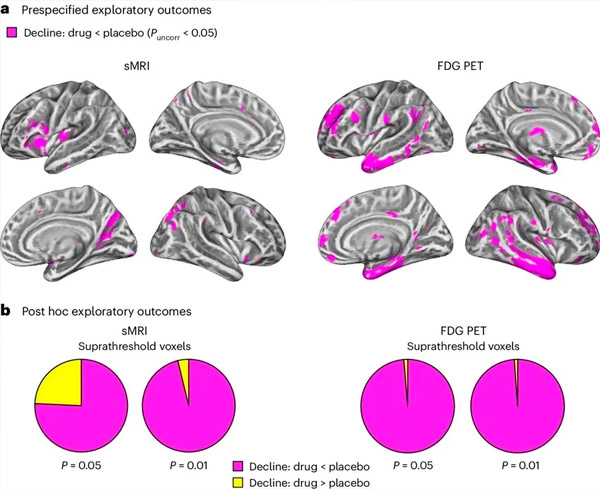
A. Tweeweg gemengde modellenanalyse van covariantie onderzocht interacties tussen behandeling (medicijn of placebo) en tijd (voor of na behandeling). Een eenzijdige t-contrastanalyse die de interactiehypothese (medicijn vertraagt progressie vergeleken met placebo) onderzocht, toonde aan dat behandeling met LM11A-31 longitudinale degeneratie (linkerpanelen) en glucosehypometabolisme (rechterpanelen) vertraagde in de medicijngroep (cMRI, n = 127; PET, n = 121) vergeleken met de placebogroep (cMRI, n = 66; PET, n = 62). Voxels die deze interactie aantonen, worden weergegeven bij een ongecorrigeerde drempelwaarde van P < 0,05 (magenta) op een populatiespecifiek corticaal oppervlak. De linker- en rechterhemisferen worden respectievelijk in de bovenste en onderste rij weergegeven. Hersengebieden die interacties vertonen die niet in overeenstemming zijn met de hypothese, worden weergegeven in Figuur 7 in de Aanvullende Gegevens.
B. Totaal aantal voxels in vooraf gedefinieerde kwetsbare hersengebieden voor AD (totale oppervlakte van cirkeldiagrammen) die ofwel een interactie vertonen die overeenkomt met de hypothese (magenta) ofwel een interactie die inconsistent is met de hypothese (geel) in elke beeldvormende modaliteit (cMRI, linkerpaneel; FDG PET, rechterpaneel) bij steeds ruimere drempelwaarden van ongecorrigeerde P < 0,01 en P < 0,05. Monte Carlo-simulaties lieten zien dat de verhoudingen van voxels die effecten vertoonden die overeenkwamen met de hypothese versus die inconsistent waren met de hypothese significant hoger waren dan die waargenomen op basis van willekeurig gegenereerde data voor zowel cMRI als PET (P < 0,001 voor elke modaliteit; tweezijdige toets).
LM11A-31 verminderde effectief de toename van Aβ42 en Aβ40 in het hersenvocht vergeleken met de placebogroep. Het medicijn liet ook een afname zien van de mediane jaarlijkse procentuele verandering in de presynaptische eiwitbiomarker SNAP25 en een afname van de postsynaptische biomarker NG, wat wijst op een vertraging van het verlies van presynaptische en postsynaptische verbindingen. LM11A-31 verminderde ook de toename van YKL40, wat leidde tot een daling van de MMSE-scores en een stijging van de ADAS-Cog-13-scores. Het medicijn verminderde ook het verlies van grijze stof in de frontale kwab en de posterieure pariëtale cortex en een afname van het glucosemetabolisme in gebieden zoals de entorinale cortex, temporale cortex, hippocampus, insulaire cortex en prefrontale cortex.
Conclusie
De studie concludeerde dat modulatie van p75NTR door LM11A-31 geschikt is voor grotere klinische studies. LM11A-31 voldeed aan het primaire veiligheidseindpunt en werd goed verdragen door patiënten met milde tot ernstige AD. De resultaten wijzen op de noodzaak van verdere studies met langere behandelduren om het potentieel van kleine moleculen voor de regulering van p75NTR als ziektemodificerende therapie bij AD te evalueren. De studie toonde aan dat LM11A-31 een significante invloed had op verschillende biomarkers, waaronder Aβ40, Aβ42, SNAP25, NG en YKL40, wat wijst op een vertraging van de pathologische progressie. Toekomstige studies kunnen mogelijk aanvullende indicatoren voor de gezondheid van gliacellen evalueren.
