Nieuwe publicaties
Belang van ritmiek in het immuunsysteem voor tumorgroei
Laatst beoordeeld: 02.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Door de veranderingen in het immuunsysteem van tumoren gedurende de dag te bestuderen, tonen wetenschappers van de Universiteit van Genève en de Ludwig Maximilian-Universiteit in München aan welke impact deze veranderingen hebben op de diagnose en behandeling van patiënten.
De meest veelbelovende antitumorbehandelingen die momenteel beschikbaar zijn, zijn immunotherapieën, die gericht zijn op het versterken van het immuunsysteem van patiënten in de strijd tegen kanker. Ondanks de hoge effectiviteit van deze methoden in sommige gevallen, valt hun succes echter soms tegen. Hoe kan deze variabiliteit worden verklaard?
In eerdere studies ontdekte een team van de Universiteit van Genève (UNIGE) en de Ludwig Maximilian Universiteit München (LMU) dat het ritme van het immuunsysteem belangrijk is voor tumorgroei. Dezelfde wetenschappers hebben nu aangetoond dat het immuunprofiel van tumoren aanzienlijk varieert, afhankelijk van het tijdstip waarop de biopten worden genomen.
Deze tijdelijke veranderingen kunnen leiden tot een verkeerde diagnose en een onjuiste behandeling. Bovendien kunnen sommige voorheen genegeerde therapeutische doelen cruciaal blijken in de strijd tegen de ziekte. De bevindingen, gepubliceerd in het tijdschrift Cell, kunnen belangrijke implicaties hebben voor de klinische zorg en de ontdekking van geneesmiddelen.
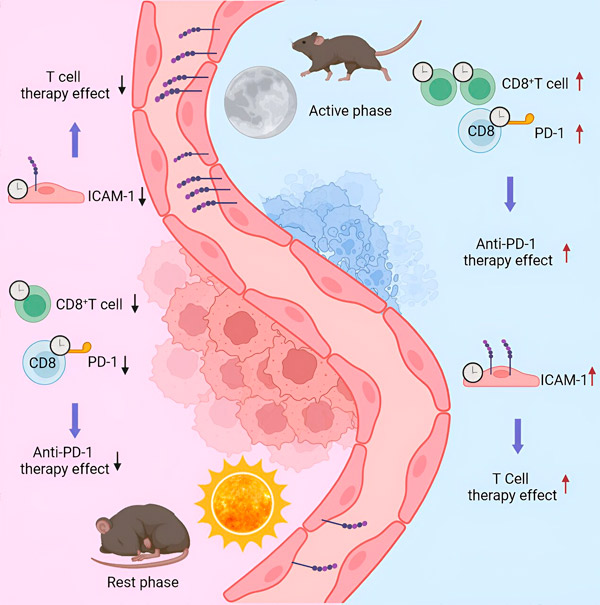
In 2022 observeerde een onderzoeksteam onder leiding van Christoph Scheiermann, hoogleraar aan de afdeling Pathologie en Immunologie en het Centrum voor Ontstekingsonderzoek aan de medische faculteit van de UNIGE en de Universiteit München, een onverwacht fenomeen: de groei en ernst van tumoren waren gekoppeld aan het circadiane ritme van immuuncellen. "Maar om deze resultaten in een klinische context te gebruiken, moesten we de details ervan begrijpen in een model dat de realiteit dicht benadert", aldus Scheiermann.
Om dit te doen, injecteerden de wetenschappers een groep muizen met melanoomcellen en verzamelden ze de resulterende tumoren twee weken later op verschillende tijdstippen van de dag. Afhankelijk van het tijdstip van de dag en dus van de immuunactivatie van het dier, varieerden het aantal immuuncellen, evenals hun type en kenmerken, aanzienlijk. Dit kan belangrijke implicaties hebben in de klinische praktijk.
Bron: Cell (2024). DOI: 10.1016/j.cell.2024.04.015
"In het ziekenhuis ondergaan patiënten een biopsie om de tumor en de immuunkenmerken ervan te identificeren", legt Scheierman uit. "Op basis van deze beoordeling wordt vervolgens de behandeling, en met name immunotherapie, bepaald. Afhankelijk van het moment van de biopsie kan het aantal geïnfiltreerde immuuncellen nu zeer hoog zijn – en wordt de tumor geclassificeerd als 'heet' – of zeer laag ('koud'), ook al gaat het om dezelfde tumor. Een biopsie op het verkeerde moment uitvoeren kan leiden tot een onjuiste diagnose."
Een blik op de timing van immunotherapieën
Om zo dicht mogelijk bij de klinische realiteit te komen, pasten de wetenschappers twee goedgekeurde en veelgebruikte behandelingen toe op hun groepen muizen: CAR-T-cellen (speciaal ontworpen om tumorspecifieke eiwitten te herkennen en aan te pakken) en immuuncheckpointremmers, die de natuurlijke remmen van het immuunsysteem onderdrukken om zo de activering van het immuunsysteem tegen tumoren te versterken.
"Als ze op het verkeerde moment werden toegediend, hadden deze behandelingen geen effect. Als ze op het juiste moment werden toegediend, kon de tumorlast aanzienlijk worden verminderd", legt Scheierman uit. "Het aantal immuuncellen dat in de tumor aanwezig of afwezig is, speelt een rol, maar ook hun kenmerken en gedrag."
Afhankelijk van de modulatie van de moleculaire elementen die voor deze behandelingen worden gebruikt, wordt het moment van toediening cruciaal. Op het juiste moment worden de te vernietigen cellen direct herkend. Op het verkeerde moment worden de doelmoleculen minder sterk tot expressie gebracht en heeft het medicijn geen effect.
Aanpassing van schema's en behandelmethoden
Deze studies bij muizen worden ondersteund door analyses van de overlevingskansen van patiënten na immunotherapie. Ochtendbehandeling – op het hoogtepunt van de immuunactivatie bij mensen – wordt systematisch geassocieerd met betere overlevingskansen. Er zijn studies gepland om de impact van het aanpassen van het tijdstip van screening en behandeling op patiënten te beoordelen. Andere projecten zullen potentiële medicijndoelen onderzoeken die tot nu toe onderschat zijn.
Deze ontdekkingen over immuunritmes hebben bovendien nog bredere implicaties: enerzijds voor gepersonaliseerde geneeskunde, om therapeutische benaderingen aan te passen aan de temporele profielen van patiënten (10-20% van de mensen heeft een biologisch ritme dat niet samenvalt met dat van de algemene bevolking), en anderzijds in de context van andere pathologieën, met name auto-immuunziekten.
