Nieuwe publicaties
Nieuwe bevindingen dragen bij aan een beter begrip van de oorzaken van het Rett-syndroom
Laatst beoordeeld: 02.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.

Het Rettsyndroom is een zeldzame neurologische ontwikkelingsstoornis waarvoor momenteel geen genezing of goede behandeling bestaat. Het veroorzaakt ernstige fysieke en cognitieve symptomen, waarvan er veel overlappen met autismespectrumstoornissen.
Het Rettsyndroom wordt veroorzaakt door mutaties in het MECP2-gen, dat sterk tot expressie komt in de hersenen en een belangrijke rol lijkt te spelen bij het behoud van de gezondheid van neuronen. Het gen bevindt zich op het X-chromosoom en het syndroom treft voornamelijk meisjes. Om behandelingen voor het Rettsyndroom te ontwikkelen, willen onderzoekers MECP2 en de functies ervan in de hersenen beter begrijpen.
Onderzoekers, waaronder medeoprichter van het Whitehead Institute Rudolf Jaenisch, bestuderen MECP2 al tientallen jaren, maar veel basisfeiten over het gen bleven onbekend. Het eiwit dat door het gen wordt gecodeerd, MECP2, is betrokken bij genregulatie; het bindt zich aan DNA en beïnvloedt de expressieniveaus van diverse andere genen, oftewel de hoeveelheid eiwit die ze produceren.
Onderzoekers hadden echter geen complete lijst van genen die door MECP2 worden beïnvloed en er was geen consensus over hoe MECP2 deze genen beïnvloedt.
Vroege studies naar MECP2 suggereerden dat het een repressor was die de expressie van zijn doelwitgenen verminderde, maar onderzoek door Jaenisch en anderen had eerder aangetoond dat MECP2 ook als activator werkt en de expressie van zijn doelwitgenen verhoogt – en dat het mogelijk in de eerste plaats een activator is. Ook het werkingsmechanisme van MECP2, of wat het eiwit precies doet om veranderingen in genexpressie te veroorzaken, was onbekend.
Technologische beperkingen hebben onderzoekers verhinderd duidelijkheid te krijgen over deze vragen. Maar Yanish, postdoc Yi Liu van zijn lab, en Yanish' voormalig lablid Anthony Flamier, nu universitair docent aan het onderzoekscentrum CHU Sainte-Justine van de Université de Montréal, hebben geavanceerde technieken gebruikt om deze resterende vragen over MECP2 te beantwoorden en nieuwe inzichten te verkrijgen in de rol ervan bij hersengezondheid en -ziekten.
Hun resultaten werden gepubliceerd in het tijdschrift Neuron en de onderzoekers creëerden ook een online databank van hun MECP2-gegevens, de MECP2-NeuroAtlas-portal, als bron voor andere onderzoekers.
"Ik denk dat dit artikel het begrip van hoe MECP2 het Rett-syndroom veroorzaakt fundamenteel zal veranderen. We hebben een volledig nieuw begrip van het mechanisme en het kan nieuwe mogelijkheden bieden voor de ontwikkeling van behandelingen voor de ziekte", zegt Janisch, tevens hoogleraar biologie aan het MIT.
Dieper inzicht in MECP2 in de hersenen
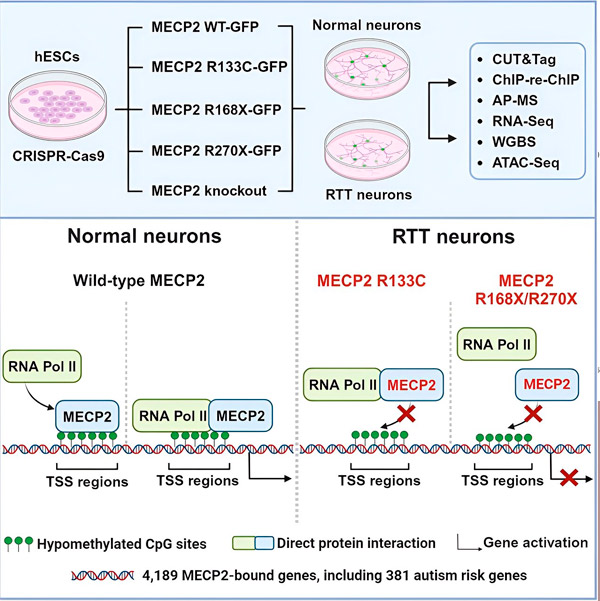
De onderzoekers maakten eerst een gedetailleerde kaart van waar MECP2 zich bindt in menselijke neuronale gensequenties, ofwel binnen genen ofwel in regulerende DNA-regio's in de buurt ervan. Ze gebruikten een aanpak genaamd CUT&Tag, die eiwitinteracties met DNA zeer nauwkeurig kan lokaliseren.
De onderzoekers vonden meer dan 4000 genen die geassocieerd zijn met MECP2. Ze herhaalden hun mapping in neuronen met veelvoorkomende MECP2-mutaties die geassocieerd worden met het Rett-syndroom om te bepalen waar MECP2 in de ziektetoestand uitgeput is.
Door te weten aan welke genen MECP2 zich bindt, konden Liu en Flamier verbanden leggen tussen de targets van MECP2 en de gezondheid van de hersenen. Ze ontdekten dat veel van de targets betrokken zijn bij de ontwikkeling en functie van neuronale axonen en synapsen.
Ze vergeleken hun lijst met MECP2-doelen ook met de database van autisme-geassocieerde genen van het Simons Foundation Autism Research Initiative (SFARI) en ontdekten dat 381 genen in die database MECP2-doelen zijn.
Bron: Neuron (2024). DOI: 10.1016/j.neuron.2024.04.007
Deze bevindingen kunnen helpen de mechanismen te verhelderen die ten grondslag liggen aan autismesymptomen bij het Rett-syndroom en vormen een goed startpunt voor onderzoek naar de mogelijke rol van MECP2 bij autisme.
"We hebben de eerste geïntegreerde kaart van het MECP2-epigenoom in gezondheid en ziekte gemaakt, en deze kaart kan toekomstig onderzoek sturen", zegt Liu. "Weten welke genen doelwit zijn van MECP2 en welke genen direct verstoord worden bij de ziekte, biedt een solide basis voor het begrijpen van het Rett-syndroom en het stellen van vragen over genregulatie in neuronen."
De onderzoekers keken ook of MECP2 de expressie van zijn doelgenen verhoogde of verlaagde. In lijn met de geschiedenis waarin MECP2 door sommigen als activator en door anderen als repressor werd geïdentificeerd, vonden Liu en Flamier voorbeelden waarbij MECP2 beide rollen vervulde.
Hoewel MECP2 vaker als een repressor wordt beschouwd, ontdekten Liu en Flamier dat het vooral een activator is – wat eerdere bevindingen van Jaenisch en Liu bevestigt. Een nieuw experiment toonde aan dat MECP2 minstens 80% van zijn doelwitten activeert, en een ander experiment toonde aan dat het tot 88% van zijn doelwitten activeert.
De door de onderzoekers gemaakte kaart van doelgenen gaf extra inzicht in de rol van MECP2 als activator. Ze ontdekten dat genen die MECP2 activeert, zich doorgaans binden aan een DNA-regio stroomopwaarts van het gen, de zogenaamde transcriptiestartplaats.
Dit is de plaats waar cellulaire machines het proces van het transcriberen van een gen naar RNA initiëren, waarna het RNA wordt vertaald naar een functioneel eiwit, het product van genexpressie. De aanwezigheid van MECP2 op de startplaats van de transcriptie, waar genexpressie begint, is consistent met zijn rol als genactivator.
De onderzoekers gingen vervolgens op zoek naar de rol die MECP2 speelt bij genactivering. Ze keken naar de moleculen waaraan MECP2 zich op deze plek bindt, naast DNA, en ontdekten dat MECP2 direct interageert met een eiwitcomplex genaamd RNA-polymerase II (RNA Pol II). RNA Pol II is een belangrijke cellulaire machine die DNA omzet in RNA. RNA Pol II kan genen niet zelfstandig vinden, dus heeft het verschillende cofactoren, oftewel eiwit-collaborateurs, nodig om zijn werk te kunnen doen.
De onderzoekers stellen voor dat MECP2 als een dergelijke cofactor fungeert en RNA Pol II helpt bij het initiëren van transcriptie bij genen waaraan MECP2 bindt. Structurele analyse van MECP2 heeft delen van het molecuul geïdentificeerd die binden aan RNA Pol II, en andere experimenten hebben bevestigd dat verlies van MECP2 de aanwezigheid van RNA Pol II op geschikte transcriptiestartplaatsen vermindert, evenals de expressieniveaus van doelgenen.
Dit suggereert dat het Rett-syndroom mogelijk wordt veroorzaakt door een verminderde transcriptie van genen die het doelwit zijn van MECP2, als gevolg van MECP2-mutaties die de binding aan RNA Pol II of aan DNA verhinderen. In lijn met dit idee zijn de meest voorkomende MECP2-mutaties die met de ziekte worden geassocieerd, truncaties: mutaties waarbij een deel van het eiwit ontbreekt, wat de interactie tussen MECP2 en RNA Pol II kan beïnvloeden.
De onderzoekers hopen dat hun bevindingen niet alleen ons begrip van MECP2 zullen veranderen, maar dat een dieper en breder begrip van hoe MECP2 de ontwikkeling en functie van de hersenen beïnvloedt, kan leiden tot nieuwe inzichten die nuttig kunnen zijn voor mensen met het Rett-syndroom en verwante aandoeningen, waaronder autisme.
"Dit project is een geweldig voorbeeld van de samenwerking binnen het Janisch-lab", aldus Flamier. "Rudolf en ik hadden een specifiek probleem met betrekking tot het Rett-syndroom, en ik had ervaring met de CUT&Tag-technologie, die het probleem zou kunnen oplossen. Door overleg realiseerden we ons dat we onze krachten konden bundelen, en nu beschikken we over een uitgebreide bron van informatie over MECP2 en de link met ziekte."
