Nieuwe publicaties
Derivaten van thalidomideverbindingen leiden tot de dood van resistente kankercellen
Laatst beoordeeld: 02.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Een onderzoek van de Goethe-Universität in Frankfurt wijst op de mogelijkheid dat thalidomidederivaten mogelijk gebruikt kunnen worden voor de behandeling van kanker. Thalidomide werd in de jaren vijftig als slaapmiddel verkocht. Later werd het berucht vanwege de ernstige geboorteafwijkingen die het in de vroege stadia van de zwangerschap veroorzaakte.
Het is ook bekend dat het molecuul eiwitten in de cel markeert voor vernietiging. In het kader van de huidige studie hebben wetenschappers derivaten van thalidomide ontwikkeld. Ze konden aantonen dat deze stoffen de vernietiging van eiwitten beïnvloeden die verantwoordelijk zijn voor het voortbestaan van kankercellen.
Misschien heeft geen enkel ander molecuul zo'n turbulent verleden gehad als thalidomide. Het was het hoofdbestanddeel van een medicijn dat in de jaren vijftig in veel landen werd goedgekeurd als kalmeringsmiddel en slaapmiddel. Maar al snel werd duidelijk dat zwangere vrouwen die thalidomide gebruikten, vaak baby's met ernstige afwijkingen ter wereld brachten.
De afgelopen decennia heeft de geneeskunde er echter opnieuw grote hoop op gevestigd. Studies hebben onder andere aangetoond dat het de groei van bloedvaten remt en daardoor potentieel geschikt is om tumoren van hun voedingsbodem te ontdoen. Het bleek vervolgens ook zeer effectief bij de behandeling van multipel myeloom, kwaadaardige tumoren in het beenmerg.
"We weten nu dat thalidomide een 'moleculaire lijm' genoemd kan worden", legt dr. Xinglai Cheng van het Instituut voor Farmaceutische Chemie aan de Goethe-Universität Frankfurt uit. "Dit betekent dat het twee eiwitten kan vastpakken en aan elkaar kan plakken."
Dit is met name interessant omdat een van deze eiwitten een soort ‘etiketteermachine’ is: het plakt een eenduidig ‘GARBAGE’-label op een ander eiwit.
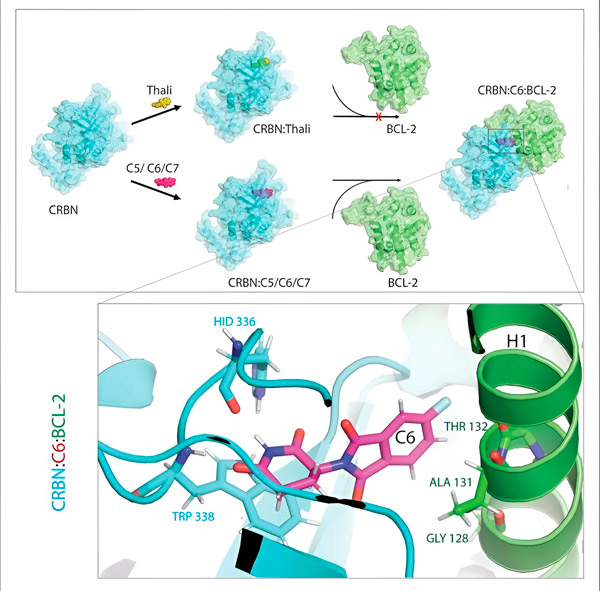
Thalidomidederivaten C5, C6 en C7 veranderen CRBN, de "labelmachine", zodat het zich kan binden aan BCL-2. Op deze manier wordt het BCL-2-molecuul gemarkeerd voor afbraak – een mogelijke nieuwe strategie in de strijd tegen kanker. Auteur: Dr. Xinglai Cheng.
Het afvalverwerkingssysteem van de cel herkent dit label: het pakt het gemarkeerde eiwitmolecuul en versnippert het. "Dit mechanisme verklaart de verschillende effecten van thalidomide", zegt Cheng. "Afhankelijk van welk eiwit gemarkeerd is, kan het misvormingen veroorzaken tijdens de embryonale ontwikkeling of kwaadaardige cellen vernietigen."
Dit mechanisme opent enorme mogelijkheden voor de geneeskunde, aangezien kankercellen afhankelijk zijn van bepaalde eiwitten om te overleven. Als ze systematisch zouden kunnen worden aangepakt en vernietigd, zou de ziekte misschien genezen kunnen worden. Het probleem is dat de moleculaire lijm nogal eigenaardig is.
Een van de bindingspartners is altijd de labelmachine van de cel, of, in wetenschappelijke termen, een E3-ligase genaamd CRBN. Slechts een paar van de vele duizenden eiwitten in het lichaam kunnen de tweede partner zijn – welke dat zijn, hangt af van de lijm.
"Dus hebben we een reeks thalidomidederivaten gecreëerd", zegt Cheng. "Vervolgens hebben we getest of ze hechtende eigenschappen hadden en, zo ja, tegen welke eiwitten ze effectief waren." Om dit te doen, voegden de onderzoekers hun derivaten toe aan alle eiwitten in de gekweekte cellijn. Vervolgens observeerden ze welke van deze eiwitten vervolgens werden afgebroken in aanwezigheid van CRBN.
"Tijdens dat proces hebben we drie derivaten geïdentificeerd die een cellulair eiwit kunnen markeren dat zeer belangrijk is voor de afbraak, BCL-2," legt Cheng uit. "BCL-2 voorkomt dat de cellen hun zelfvernietigingsprogramma activeren, dus als het er niet is, sterven de cellen."
Daarom is BCL-2 al lang een focus van kankeronderzoek. Er is zelfs een leukemiedrug genaamd venetoclax die de effectiviteit van BCL-2 vermindert en zo gemuteerde cellen tot zelfvernietiging aanzet.
"In veel kankercellen is BCL-2 echter zelf gemuteerd. Daardoor remt venetoclax het eiwit niet langer", zegt Cheng. "We konden aantonen dat onze derivaten ook deze gemuteerde vorm markeren voor afbraak. Bovendien simuleerden onze partners van het Max Planck Instituut voor Biofysica de interactie van thalidomidederivaten met BCL-2 op een computer. Dit toonde aan dat de derivaten zich aan compleet andere plaatsen binden dan venetoclax - een resultaat dat we later experimenteel konden bevestigen."
De onderzoekers testten hun verbindingen ook op fruitvliegjes met kankercellen. De overlevingskans van de op deze manier behandelde vliegjes was aanzienlijk hoger. Cheng waarschuwt echter tegen te hoge verwachtingen, aangezien deze resultaten nog steeds fundamenteel onderzoek zijn. "Hoewel ze aantonen dat de gemodificeerde thalidomidemoleculen een groot therapeutisch potentieel hebben, kunnen we nog niet zeggen of ze zich op enig moment in de praktijk zullen bewijzen."
De resultaten van het onderzoek zijn gepubliceerd in het tijdschrift Cell Reports Physical Science.
