Het verduidelijken van de cellulaire mechanismen van parodontitis met een verbeterd diermodel
Laatst beoordeeld: 14.06.2024

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Onderzoekers van de Tokyo Medical and Dental University (TMDU) hebben een techniek ontwikkeld waarmee ze de ontwikkeling van parodontitis in de loop van de tijd gedetailleerd kunnen analyseren.
Parodontitis, vertegenwoordigd door parodontitis, is de belangrijkste oorzaak van tandverlies en treft bijna één op de vijf volwassenen wereldwijd. In de meeste gevallen treedt deze aandoening op als gevolg van een ontstekingsreactie op een bacteriële infectie van de weefsels rond de tanden.
Naarmate de toestand verslechtert, begint het tandvlees terug te trekken, waardoor de wortels van de tanden en het bot zichtbaar worden. Met name de incidentie van parodontitis neemt toe met de leeftijd, en naarmate de levensverwachting van bevolkingen over de hele wereld toeneemt, is het belangrijk om een goed inzicht te hebben in de onderliggende oorzaken en progressie ervan.
In een studie gepubliceerd in Nature Communications vonden TMDU-onderzoekers een manier om dit doel te bereiken door een veelgebruikt diermodel voor het bestuderen van parodontitis te verbeteren.
Direct onderzoek naar parodontitis bij mensen is moeilijk. Als gevolg hiervan wenden wetenschappers zich vaak tot diermodellen voor preklinisch onderzoek. Het ‘muizenligatie-geïnduceerde parodontitismodel’ heeft onderzoekers sinds de introductie ervan in 2012 bijvoorbeeld in staat gesteld de cellulaire mechanismen te bestuderen die ten grondslag liggen aan deze aandoening.
Simpel gezegd: in dit model wordt parodontitis kunstmatig geïnduceerd door zijden hechtingen op de kiezen van muizen te plaatsen, wat ophoping van tandplak veroorzaakt. Hoewel deze methode handig en effectief is, dekt deze niet het volledige beeld van parodontitis.
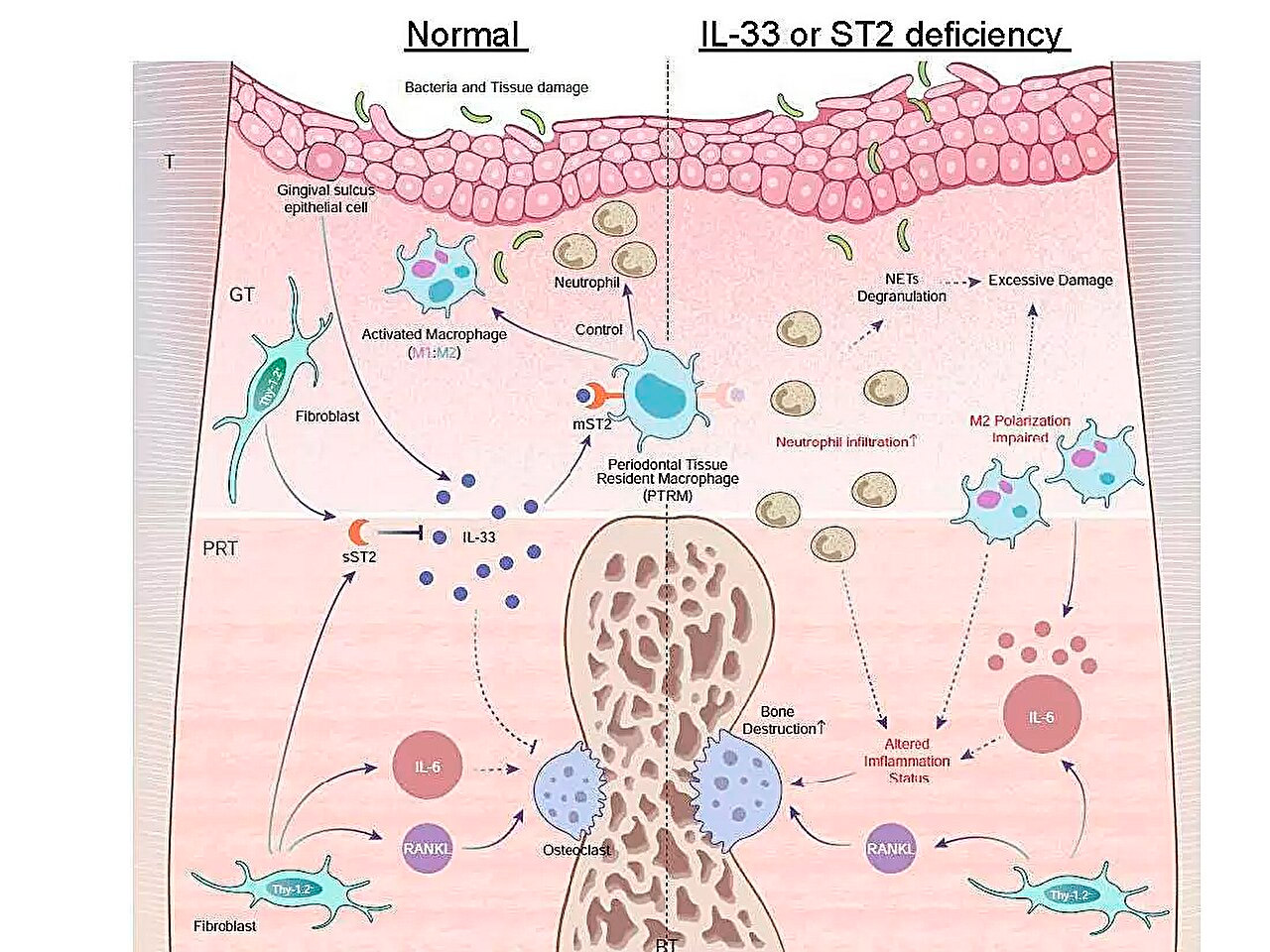
Schematische illustratie van inflammatoire genexpressieprofielen tijdens parodontitis en de rol van de IL-33/ST2-as bij het beheersen van acute ontstekingen. Bron: Tokyo Medical and Dental University.
"Hoewel parodontaal weefsel bestaat uit gingiva, parodontaal ligament, alveolair bot en cement, wordt de analyse doorgaans uitsluitend uitgevoerd op tandvleesmonsters vanwege technische en kwantitatieve beperkingen", merkt hoofdonderzoeksauteur Anhao Liu op. "Deze bemonsteringsstrategie beperkt de conclusies die uit deze onderzoeken kunnen worden getrokken, dus zijn er methoden nodig die alle weefselcomponenten tegelijkertijd kunnen analyseren."
Om deze beperking aan te pakken, heeft het onderzoeksteam een aangepast model van ligatuur-geïnduceerde parodontitis ontwikkeld. In plaats van de klassieke enkele ligatuur gebruikten ze een drievoudige ligatuur op de kies linksboven bij mannelijke muizen. Deze strategie breidde het gebied van botverlies uit zonder significante botvernietiging rond de tweede kies, waardoor het aantal verschillende soorten parodontaal weefsel toenam.
"We isoleerden drie belangrijke weefseltypen en beoordeelden de RNA-opbrengst tussen de twee modellen. De resultaten toonden aan dat het drievoudige ligatiemodel de opbrengst effectief verhoogde, waardoor vier keer de hoeveelheid normaal periradiculair weefsel werd bereikt en analyse met hoge resolutie van verschillende weefseltypen werd ondersteund ”, legt Sr. Uit door Dr. Mikihito Hayashi.
Nadat ze de effectiviteit van hun aangepaste model hadden bevestigd, begonnen de onderzoekers de effecten van parodontitis op genexpressie in verschillende weefseltypen in de loop van de tijd te bestuderen, waarbij ze zich concentreerden op genen die geassocieerd zijn met ontstekingen en osteoclastdifferentiatie.
Een van hun belangrijkste bevindingen was dat de Il1rl1-genexpressie vijf dagen na ligatie significant hoger was in periradiculair weefsel. Dit gen codeert voor het ST2-eiwit in receptor- en lokisovormen, dat zich bindt aan een cytokine genaamd IL-33, dat betrokken is bij ontstekings- en immuunregulerende processen.
Om meer inzicht te krijgen in de rol van dit gen, induceerde het team parodontitis bij genetisch gemodificeerde muizen die de Il1rl1- of Il33-genen misten. Deze muizen vertoonden versnelde inflammatoire botvernietiging, wat de beschermende rol van de IL-33/ST2-route benadrukt. Verdere analyse van cellen die het ST2-eiwit in zijn receptorvorm, mST2, bevatten, toonde aan dat het merendeel afkomstig was van macrofagen.
"Macrofagen worden over het algemeen ingedeeld in twee hoofdtypen, pro-inflammatoire en anti-inflammatoire, afhankelijk van hun activering. We hebben ontdekt dat cellen die mST2 tot expressie brengen uniek zijn omdat ze tegelijkertijd enkele markers van beide typen macrofagen tot expressie brengen", aldus senior auteur Dr. Takanori Iwata. "Deze cellen waren aanwezig in het periradiculaire weefsel vóór het begin van de ontsteking, dus noemden we ze 'residente parodontale macrofagen'."
Samen tonen de resultaten van dit onderzoek de kracht aan van het aangepaste diermodel om parodontitis op een meer gedetailleerde schaal te bestuderen, tot op biomoleculair niveau.
"Wij stellen de mogelijkheid voor van een nieuwe moleculaire route, IL-33/ST2, die ontstekingen en botvernietiging bij parodontitis reguleert, samen met specifieke macrofagen in het periradiculaire weefsel, dat nauw betrokken is bij parodontitis. Dit zal hopelijk leiden aan de ontwikkeling van nieuwe behandelstrategieën en preventiemethoden”, besluit senior auteur Dr. Tomoki Nakashima.
