Nieuwe publicaties
ARID1A genmutatie maakt tumoren gevoelig voor immuuntherapie
Laatst beoordeeld: 02.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Immunotherapie heeft de kankerbehandeling de afgelopen jaren radicaal veranderd. In plaats van tumoren direct aan te pakken, richt immunotherapie het immuunsysteem van de patiënt erop om tumoren effectiever aan te vallen. Dit is met name effectief bij sommige moeilijk te behandelen vormen van kanker. Minder dan de helft van alle kankerpatiënten reageert echter op de huidige immunotherapieën, waardoor er dringend behoefte is aan biomarkers die kunnen voorspellen welke patiënten waarschijnlijk het meest baat zullen hebben bij de behandeling.
Onlangs hebben wetenschappers opgemerkt dat patiënten met tumoren met een mutatie in het ARID1A-gen vaker positief reageren op immuuncheckpointblokkade, een type immuuntherapie dat werkt door de immuuncellen die kanker bestrijden geactiveerd te houden.
Omdat de ARID1A-genmutatie aanwezig is bij veel soorten kanker, waaronder baarmoederkanker, eierstokkanker, colorectale kanker, maagkanker, leverkanker en alvleesklierkanker, vroegen onderzoekers van het Salk Institute zich af hoe de mutatie zou kunnen bijdragen aan de behandelingsgevoeligheid en hoe clinici deze informatie zouden kunnen gebruiken om de kankerbehandeling voor iedere patiënt te personaliseren.
Uit hun nieuwe onderzoek, gepubliceerd in het tijdschrift Cell, blijkt dat de ARID1A-mutatie tumoren gevoeliger maakt voor immunotherapie, door kankerbestrijdende immuuncellen naar de tumor te lokken via een immuunreactie die lijkt op die van een antiviraal middel.
De onderzoekers suggereren dat deze mutatie en de antivirale immuunrespons gebruikt kunnen worden als biomarker om patiënten beter te selecteren voor specifieke immunotherapieën, zoals immuuncheckpointblokkering. Deze bevindingen stimuleren ook de ontwikkeling van medicijnen die gericht zijn op ARID1A en verwante eiwitten om andere tumoren gevoeliger te maken voor immunotherapie.
"Dit zou de uitkomst van kankerbehandelingen voor patiënten echt kunnen veranderen", aldus universitair hoofddocent Diana Hargreaves, hoofdauteur van de studie. "Patiënten met de ARID1A-mutatie hebben al een immuunreactie, dus het enige wat we hoeven te doen is die reactie te versterken met immuuncontrolepuntblokkering om hen te helpen hun tumoren van binnenuit te vernietigen."
Hoewel bekend was dat mensen met ARID1A-mutaties goed reageerden op immuuncontrolepuntblokkade, bleef het exacte verband tussen beide onduidelijk. Om meer inzicht te krijgen in het mechanisme, gebruikten wetenschappers van het Salk Institute muismodellen van melanoom en colorectale kanker met zowel de ARID1A-mutatie als functioneel ARID1A.
Bron: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Het team observeerde een robuuste immuunrespons in alle modellen met de ARID1A-mutatie, maar niet in de modellen waarbij ARID1A functioneel was. Dit ondersteunt het idee dat de ARID1A-mutatie inderdaad deze respons aanstuurt. Maar hoe werkt dit op moleculair niveau?
"We ontdekten dat ARID1A een belangrijke rol speelt in de celkern door de juiste DNA-organisatie te handhaven", zegt Matthew Maxwell, eerste auteur van de studie en promovendus in het laboratorium van Hargreaves. "Zonder functioneel ARID1A kan vrij DNA worden verwijderd en in het cytosol worden vrijgegeven, waardoor een gewenste antivirale immuunrespons wordt geactiveerd die kan worden versterkt door blokkering van immuuncontrolepunten."
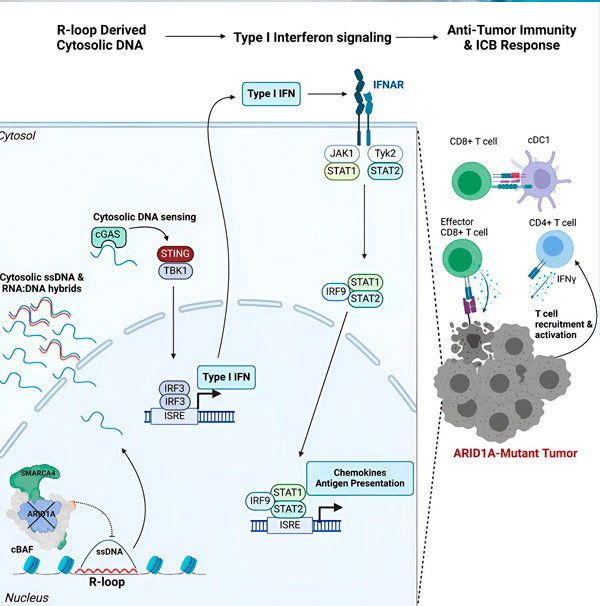
Het ARID1A-gen codeert voor een eiwit dat helpt bij het reguleren van de vorm van ons DNA en het handhaven van de stabiliteit van het genoom. Wanneer ARID1A muteert, zet het een Rube Goldberg-achtige reeks gebeurtenissen in kankercellen in gang.
Ten eerste leidt het ontbreken van functioneel ARID1A tot het vrijkomen van DNA in het cytosol. Het cytosolische DNA activeert vervolgens een antiviraal alarmsysteem, de cGAS-STING-route, omdat onze cellen zijn aangepast om elk DNA in het cytosol als vreemd te markeren ter bescherming tegen virale infecties. Uiteindelijk activeert de cGAS-STING-route het immuunsysteem om T-cellen naar de tumor te lokken en ze te activeren tot gespecialiseerde kanker-killer T-cellen.
Bij elke stap, afhankelijk van de vorige, leidt deze keten van gebeurtenissen – ARID1A-mutatie, DNA-ontsnapping, cGAS-STING-alarm, rekrutering van T-cellen – tot een toename van het aantal kankerbestrijdende T-cellen in de tumor. Immuuncontrolepuntblokkering kan vervolgens worden gebruikt om ervoor te zorgen dat deze T-cellen geactiveerd blijven, waardoor hun vermogen om kanker te bestrijden toeneemt.
"Onze bevindingen bieden een nieuw moleculair mechanisme waarmee een ARID1A-mutatie kan bijdragen aan een antitumor-immuunrespons", aldus Hargreaves. "Wat deze bevindingen zo interessant maakt, is hun translationele potentieel. We kunnen ARID1A-mutaties gebruiken om patiënten te selecteren voor immuuncontrolepuntblokkering, en we zien nu een mechanisme waarmee medicijnen die ARID1A of het eiwitcomplex ervan remmen, gebruikt kunnen worden om de immunotherapie bij andere patiënten verder te verbeteren."
Door het mechanisme te beschrijven waarmee immuuncontrolepuntblokkering effectiever is bij kanker met een ARID1A-mutatie, geven de onderzoekers clinici een reden om deze immunotherapie prioriteit te geven bij patiënten met een ARID1A-mutatie. Deze bevindingen vormen een belangrijke stap in de richting van gepersonaliseerde kankerbehandeling en inspireren de ontwikkeling van nieuwe therapieën die gericht zijn op ARID1A en het bijbehorende eiwitcomplex.
Het team van het Salk Institute hoopt dat hun bevindingen in de toekomst de behandelresultaten voor patiënten met verschillende soorten kanker die verband houden met ARID1A-mutaties zullen verbeteren. Ze willen deze klinische vertaling onderzoeken in samenwerking met de Universiteit van Californië, San Diego.
