Nieuwe publicaties
Nieuwe genetische mechanismen kunnen een therapeutisch doelwit zijn tegen glioom
Laatst beoordeeld: 02.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Een studie van het laboratorium van Shi-Yuan Cheng, PhD, professor aan de Ken en Ruth Davey-afdeling Neuro-Oncologie van de afdeling Neurologie, heeft nieuwe mechanismen geïdentificeerd die ten grondslag liggen aan alternatieve RNA-splicing in glioomtumorcellen en die mogelijk als nieuwe therapeutische doelen kunnen dienen. De onderzoeksresultaten zijn gepubliceerd in het Journal of Clinical Investigation.
"We hebben een andere manier gevonden om gliomen te behandelen door middel van alternatieve splicing. Daarnaast hebben we nieuwe doelwitten ontdekt die nog niet eerder waren geïdentificeerd, maar die belangrijk zijn voor de kwaadaardigheid van gliomen", aldus Xiao Song, MD, PhD, universitair hoofddocent neurologie en hoofdauteur van de studie.
Gliomen zijn het meest voorkomende type primaire hersentumor bij volwassenen en ontstaan uit gliacellen, die zich in het centrale zenuwstelsel bevinden en aangrenzende neuronen ondersteunen. Gliomen zijn zeer resistent tegen standaardbehandelingen, waaronder bestraling en chemotherapie, vanwege de genetische en epigenetische heterogeniteit van de tumor. Dit onderstreept de noodzaak om nieuwe therapeutische doelwitten te vinden.
Uit eerder onderzoek van het Cheng-lab, gepubliceerd in het tijdschrift Cancer Research, bleek dat de belangrijke splicingfactor SRSF3 aanzienlijk hoger ligt in gliomen vergeleken met normale hersenen. Bovendien bevordert SRSF3-gereguleerde RNA-splicing de groei en progressie van gliomen door meerdere cellulaire processen in tumorcellen te beïnvloeden.
RNA-splicing is een proces waarbij introns (niet-coderende delen van RNA) worden verwijderd en exonen (coderende delen) worden samengevoegd om een volwassen mRNA-molecuul te vormen dat de genexpressie in een cel ondersteunt.
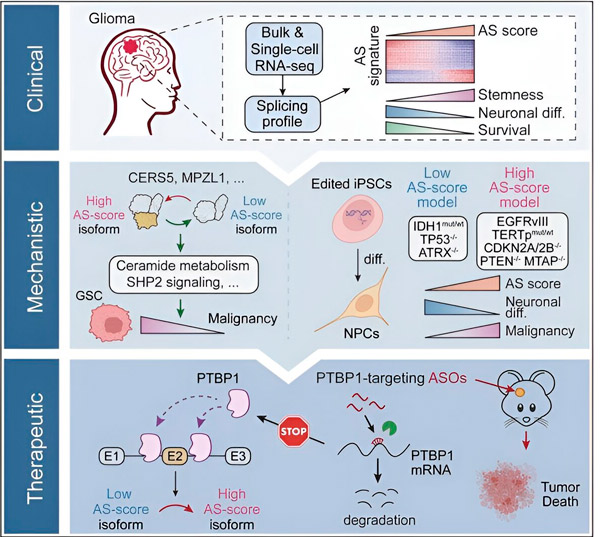
In de huidige studie wilden de wetenschappers veranderingen in alternatieve splicing in glioom-tumorcellen en de mechanismen die aan deze veranderingen ten grondslag liggen, identificeren en hun potentieel als therapeutische doelen bepalen.
Met behulp van computationele methoden en RNA-sequencingtechnologieën onderzochten de onderzoekers splicingveranderingen in glioomtumorcellen uit patiëntmonsters. Om deze veranderingen te bevestigen, gebruikten ze CRISPR-genbewerkingstechnologieën om verschillende glioomdrivermutaties te introduceren in glioommodellen afkomstig van humane geïnduceerde pluripotente stamcellen (iPSC's).
Ze ontdekten dat deze splicingveranderingen worden versterkt door een variant van de epidermale groeifactorreceptor III (EGFRIII), waarvan bekend is dat deze overgeëxprimeerd is in veel tumoren, waaronder gliomen, en dat deze veranderingen worden geremd door een mutatie in het IDH1-gen.
Onderzoekers hebben de functie bevestigd van twee RNA-splicinggebeurtenissen die verschillende proteïne-isovormen met verschillende aminozuursequenties creëren.
"Slechts één van deze isovormen kan tumorgroei bevorderen, in tegenstelling tot de andere isovorm, die normaal gesproken tot uiting komt in de normale hersenen. Tumoren gebruiken dit mechanisme om de tumorbevorderende isovorm selectief te laten groeien ten opzichte van de normale hersenisovorm", aldus Song.
Het team analyseerde vervolgens upstream RNA-bindende eiwitten en ontdekte dat het PTBP1-gen tumorbevorderende RNA-splicing in glioomcellen reguleert. Met behulp van een orthotopisch glioommodel in immuundeficiënte muizen richtten de onderzoekers PTBP1 op antisense-oligonucleotide (ASO)-gebaseerde therapie, wat uiteindelijk de tumorgroei onderdrukte.
"Onze gegevens benadrukken de rol van alternatieve RNA-splicing bij het beïnvloeden van maligniteit en heterogeniteit van gliomen en de potentie ervan als therapeutische kwetsbaarheid voor de behandeling van volwassen gliomen", schreven de auteurs van de studie.
De volgende stap voor de onderzoekers is het onderzoeken van de mogelijkheden om PTBP1 aan te pakken en zo een antitumorimmuunreactie op te wekken, aldus Song.
"Met behulp van long-read RNA-sequentieanalyse ontdekten we dat het richten op PTBP1 in glioomcellen resulteert in de productie van meerdere alternatief gesplitste transcripten die in normale weefsels ontbreken. Ons volgende project is dus om uit te zoeken of deze isovorm antigenen kan genereren, zodat het immuunsysteem de tumor beter kan herkennen", aldus Song.
Song voegde eraan toe dat hun team geïnteresseerd is in het analyseren van splicing-veranderingen in niet-tumorcellen van glioompatiënten, zoals immuuncellen.
We weten al dat splicing erg belangrijk is voor het reguleren van de functie in de cel. Het zou dus niet alleen tumorkanker moeten reguleren, maar ook de functie van immuuncellen om te bepalen of ze kanker effectief kunnen doden. Daarom voeren we ook bioinformatica-analyses uit in tumorgeïnfiltreerde immuuncellen om te zien of er een verandering in splicing optreedt nadat een immuuncel de tumor heeft geïnfiltreerd.
"Ons doel is om de rol van alternatieve splicing te bepalen bij het vormgeven van de immuunonderdrukkende tumormicro-omgeving en mogelijke doelen te identificeren voor het verbeteren van de werkzaamheid van immunotherapieën bij gliomen", aldus Song.
