Nieuwe publicaties
Het onderzoek benadrukt de noodzaak van celtype-specifieke therapieën voor HIV
Laatst beoordeeld: 02.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Onderzoekers van de Universiteit van Illinois hebben het belang aangetoond van het richten op specifieke celtypen bij de behandeling van hiv. Hun studie, gepubliceerd in het tijdschrift Proceedings of the National Academy of Sciences, is een van de eerste die de differentiële of celtypespecifieke effecten van hiv-latentiemodulatie op myeloïde cellen, een type immuuncel dat in het beenmerg wordt geproduceerd, onderzoekt.
Een van de grootste obstakels bij het elimineren van een hiv-infectie is het beheersen van de latentie, de periode waarin een geïnfecteerde cel inactief is en geen virus kan produceren. Latente hiv-cellen verzamelen zich in het lichaam op plaatsen die reservoirs worden genoemd. Latente reservoirs zijn problematisch omdat ze op elk moment virus kunnen gaan produceren.
Volledige uitroeiing van de ziekte zou de verwijdering van alle latente cellen uit het lichaam vereisen, of permanente resistentie tegen activeringsstimuli. Reactivatie kan echter worden veroorzaakt door verschillende factoren, waaronder signalen die de differentiatie van myeloïde cellen sturen.
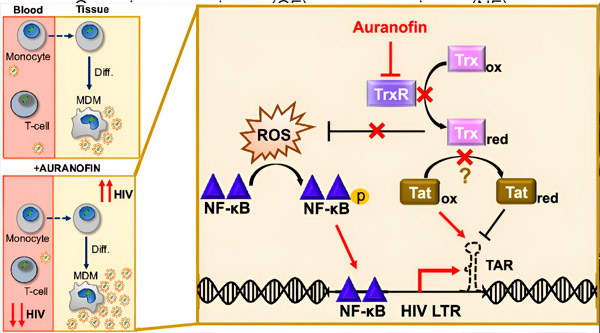
Regulering van de hiv-latentie in monocyt-afgeleide macrofagen (MDM's) kan een risico vormen voor virale verspreiding. Differentiatie van monocyten tot macrofagen kan hiv-reactivatie veroorzaken, wat mogelijk virale verspreiding in weefsels bevordert (linksboven). Een klinische kandidaat, Auranofin, vermindert viraal DNA in het bloed en bevordert de hiv-latentie in T-cellen en monocyten, maar veroorzaakt hiv-reactivatie in MDM's (linksonder). Bij MDM's veronderstellen we dat remming van TrxR door Auranofin leidt tot accumulatie van reactieve zuurstofsoorten (ROS), wat NF-κB-activering en activering van de hiv-LTR-promotor induceert (rechts). Remming van TrxR vermindert mogelijk de substraatreductie, waardoor het Tat-eiwit preferentieel geoxideerd blijft, waar het zich kan binden aan TAR en hiv-transcriptie kan initiëren. Bron: Proceedings of the National Academy of Sciences (2024). DOI: 10.1073/pnas.2313823121
Jarenlang heeft onderzoek naar hiv-genezing zich geconcentreerd op twee benaderingen die bekendstaan als 'shock and kill' en 'block and lock'. De eerste benadering werkt in combinatie met antiretrovirale therapie om latent geïnfecteerde cellen te activeren en ze te doden door apoptose, oftewel geprogrammeerde celdood, terwijl de tweede benadering geïnfecteerde cellen in een diepe latente toestand dwingt waaruit ze niet zelfstandig kunnen reactiveren.
Onderzoek naar deze technieken heeft zich traditioneel gericht op een type witte bloedcellen, T-cellen genaamd, die het primaire doelwit zijn van hiv-infecties. Latente reservoirs bestaan echter uit meer dan alleen T-cellen; ze bevatten tientallen verschillende celtypen, elk met zijn eigen unieke patronen van hiv-genexpressie.
"Er is een enorme diversiteit aan cellen, zelfs binnen één cellijn", aldus Collin Kieffer, universitair docent microbiologie en auteur van het artikel. "De variabiliteit van de respons in deze reservoirs neemt toe met elk nieuw celtype."
Alexandra Blanco, een promovendus in het laboratorium van Kieffer, wilde celtypen bestuderen die in traditioneel hiv-onderzoek over het hoofd waren gezien. Ze richtte zich op myeloïde cellen en creëerde een kloonbibliotheek met 70 populaties latent geïnfecteerde monocyten. Blanco analyseerde vervolgens de klonale populaties en hun reacties op activatie. De reacties varieerden sterk, wat de grote diversiteit binnen één celtype benadrukte.
Deze observatie riep een nieuwe vraag op: reageren verschillende celtypen echt verschillend op hiv-latentiebehandelingen? Hun bevindingen toonden inderdaad aan dat sommige hiv-latentietherapieën de latentie in T-cellen en monocyten kunnen bevorderen, terwijl ze de latentie in macrofagen kunnen omkeren.
"Niet alle cellen in het lichaam zijn hetzelfde", aldus Kieffer. "Het is dus logisch dat niet alle geïnfecteerde cellen op dezelfde manier op het virus reageren."
In hun artikel benadrukken ze dat toekomstige hiv-behandelingen rekening moeten houden met alle celtypen en hoe elke cel kan reageren op mogelijke therapieën.
Hun bevindingen bouwen voort op onderzoek van Roy Dar, een voormalig hoogleraar bio-engineering aan de Universiteit van Illinois, wiens laboratorium heterogeniteit in HIV-genexpressie bestudeerde.
"Hij is ermee begonnen, en wij hebben het overgenomen en uitgebouwd tot waar het nu is," zei Kieffer. "De samenwerking heeft deze resultaten echt op gang gebracht. Het heeft een nieuwe richting ingeslagen voor ons lab, en we zijn er erg enthousiast over."
Een extra en onverwachte bevinding uit Blanco's analyse onthulde veranderingen in celgrootte en -vorm als reactie op infectie, wat suggereert dat hiv de celmorfologie kan veranderen. Blanco's volgende doel is om de biologische mechanismen te identificeren die aan deze fenotypische veranderingen ten grondslag liggen.
Kieffer en zijn labmedewerkers kijken er ook naar uit om hun resultaten, die grotendeels in een cellijn zijn verkregen, te reproduceren in primaire cellen. Het reproduceren van de resultaten in een meer mensachtig model zou de klinische relevantie van de studie vergroten, legde Kieffer uit.
"We willen grotere screenings uitvoeren in T-cellen, monocyten en macrofagen om potentiële medicijnen te identificeren die mogelijk op al deze celtypen werken", aldus Blanco. "Misschien vinden we nog meer moleculen die zich niet op een celtype-specifieke manier gedragen."
