Eiwit verantwoordelijk voor genetische ontstekingsziekte geïdentificeerd
Laatst beoordeeld: 14.06.2024

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Een team van onderzoekers onder leiding van Dr. Hirotsugu Oda van de CECAD Cluster of Excellence for Aging Research aan de Universiteit van Keulen heeft de rol ontdekt die een specifiek eiwitcomplex speelt bij sommige vormen van immuunontregeling. Dit resultaat kan leiden tot de ontwikkeling van nieuwe therapeutische benaderingen gericht op het verminderen van de auto-inflatie en het “herstellen” van het immuunsysteem van patiënten die lijden aan een genetische disfunctie van dit eiwitcomplex.
Het onderzoek “Biallelisch menselijk SHARPIN verlies van functie induceert auto-inflammatie en immunodeficiëntie” werd gepubliceerd in Nature Immunology.
Het lineaire ubiquitine-assemblerende complex (LUBAC), bestaande uit de eiwitten HOIP, HOIL-1 en SHARPIN, wordt al lang erkend vanwege zijn cruciale rol bij het handhaven van de immuunhomeostase. Eerdere onderzoeken bij muizen hebben ernstige gevolgen aangetoond van het verlies van SHARPIN, leidend tot ernstige dermatitis als gevolg van overmatige dood van huidcellen. De specifieke gevolgen van een SHARPIN-tekort voor de menselijke gezondheid zijn tot nu toe echter onduidelijk gebleven.
Het onderzoeksteam rapporteert voor het eerst twee mensen met SHARPIN-deficiëntie die symptomen van auto-inflatie en immunodeficiëntie vertonen, maar onverwachts geen dermatologische problemen vertonen, zoals waargenomen bij muizen.
Bij verder onderzoek bleek dat deze individuen een verminderde canonieke NF-KB-respons hadden, een route die belangrijk is voor de immuunrespons. Ze hadden ook een verhoogde gevoeligheid voor celdood veroorzaakt door leden van de superfamilie tumornecrosefactor (TNF). Behandeling van een van de patiënten met SHARPIN-deficiëntie met anti-TNF-therapie, die specifiek de door TNF geïnduceerde celdood remt, resulteerde in een volledige oplossing van de auto-inflatie op cellulair niveau en in de klinische presentatie.
Onderzoek toont aan dat buitensporige en ongecontroleerde celdood een cruciale rol speelt bij menselijke genetische ontstekingsziekten. Het team van Oda heeft SHARPIN-deficiëntie toegevoegd als nieuw lid van een groep genetische menselijke ontstekingsziekten die zij 'aangeboren fouten van celdood' willen noemen.
Bescherming tegen immuundysregulatie Het onderzoek werd gestart in het laboratorium van Dr. Dan Kastner van de National Institutes of Health (NIH) in de Verenigde Staten. Wetenschappers daar konden één patiënt observeren bij wie in de kindertijd onverklaarbare episoden van koorts, artritis, colitis en immunodeficiëntie ontstonden.
Na het verkrijgen van geïnformeerde toestemming voerden ze exome-sequencing uit op de patiënt en zijn familie en ontdekten ze dat de patiënt een verstorende genetische variant in het SHARPIN-gen had, wat leidde tot niet-detecteerbare niveaus van SHARPIN-eiwit. Ze ontdekten ook dat patiëntencellen een verhoogde neiging vertoonden om te sterven, zowel in gekweekte cellen als in patiëntbiopten.
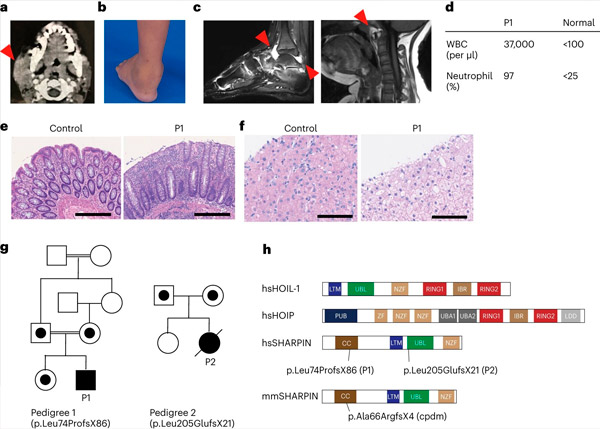
SHARPIN-tekort bij mensen veroorzaakt auto-inflammatie en leverglycogenose. Bron: Natuurimmunologie (2024). DOI: 10.1038/s41590-024-01817-w
Het team ontdekte ook dat de ontwikkeling van lymfoïde kiemcentra – gespecialiseerde microstructuren in de adenoïden die cruciaal zijn voor de rijping van de B-cellen van ons immuunsysteem en dus de productie van antilichamen – aanzienlijk werd verminderd als gevolg van de toegenomen B-celdood. Deze resultaten verklaren de immunodeficiëntie bij patiënten en benadrukken de belangrijke rol van LUBAC bij het handhaven van de immuunhomeostase bij mensen.
“Ons onderzoek benadrukt het cruciale belang van LUBAC bij de bescherming tegen ontregeling van het immuunsysteem. Door de moleculaire mechanismen op te helderen die ten grondslag liggen aan LUBAC-deficiëntie, maken we de weg vrij voor nieuwe therapeutische strategieën gericht op het herstellen van de homeostase van het immuunsysteem”, zegt Oda, hoofdauteur van de studie.
Hij voegde eraan toe: “Een van de patiënten met SHARPIN-deficiëntie was al vele jaren rolstoelafhankelijk voordat we hem voor het eerst zagen. Zijn enkels deden pijn en het was te pijnlijk om te lopen. Dankzij de genetische diagnose konden we ons richten op de juiste moleculaire route die ten grondslag ligt aan zijn aandoeningen."
Sinds de patiënt anti-TNF-therapie begon te krijgen, is hij al bijna zeven jaar symptoomvrij. “Als arts en wetenschapper ben ik blij dat ik de kans krijg om via ons onderzoek een positieve invloed te hebben op het leven van één patiënt”, besluit Oda.
