Nieuwe publicaties
Wetenschappers sporen de vroegste fysieke veranderingen in cellen op die kanker veroorzaken
Laatst beoordeeld: 02.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Wanneer kanker wordt vastgesteld, vinden er al veel gebeurtenissen op cellulair en moleculair niveau plaats die onopgemerkt zijn gebleven. Hoewel kanker voor klinische doeleinden wordt ingedeeld in vroege en late stadia, is zelfs een tumor in een "vroeg" stadium het gevolg van vele eerdere veranderingen in het lichaam die niet konden worden opgespoord.
Wetenschappers van de Yale University School of Medicine (YSM) en hun collega's hebben nu gedetailleerde inzichten gekregen in enkele van deze vroege veranderingen. Ze hebben hiervoor krachtige microscopie met hoge resolutie gebruikt om de allereerste kankerverwekkende fysieke veranderingen in de huidcellen van muizen in kaart te brengen.
Door muizen te bestuderen die een mutatie dragen die kanker in hun haarzakjes bevordert, ontdekten de wetenschappers dat de eerste tekenen van kankervorming zich voordoen op een specifiek moment en plaats in de groei van de haarzakjes van de muizen. Bovendien ontdekten ze dat deze precancereuze veranderingen kunnen worden geblokkeerd met medicijnen die bekend staan als MEK-remmers.
Het team stond onder leiding van Tianchi Xin, PhD, een onderzoeker bij de afdeling Genetica van de YSM, en bestond uit Valentina Greco, PhD, hoogleraar genetica aan het YSM en lid van het Yale Cancer Center en het Yale Stem Cell Center, en Sergi Regot, PhD, universitair hoofddocent moleculaire biologie en genetica aan de Johns Hopkins School of Medicine.
De resultaten van hun onderzoek zijn gepubliceerd in het tijdschrift Nature Cell Biology.
De wetenschappers bestudeerden muizen die plaveiselcelcarcinoom van de huid ontwikkelden, de op één na meest voorkomende vorm van huidkanker bij mensen. Deze muizen waren genetisch gemodificeerd met een kankerbevorderende mutatie in het KRAS-gen, een van de meest voorkomende gemuteerde oncogenen bij menselijke kankers. KRAS-mutaties zijn ook gevonden bij long-, alvleesklier- en colorectale kankers.
De vroege veranderingen die de wetenschappers bestudeerden, omvatten de groei van een klein, abnormaal bultje in de haarfollikel, wat geclassificeerd wordt als een precancereuze afwijking. "Inzicht in deze vroege processen kan ons helpen bij het ontwikkelen van methoden om te voorkomen dat kanker zich uiteindelijk ontwikkelt", aldus Xin, de eerste auteur van de studie.
Hoewel hun onderzoek zich richt op huidkanker, zijn de onderzoekers van mening dat de principes die zij hebben ontdekt, ook toepasbaar zijn op veel andere vormen van kanker die worden veroorzaakt door KRAS-mutaties. Dit komt omdat de belangrijkste genen en eiwitten die bij deze processen betrokken zijn, in alle tumoren hetzelfde zijn.
Meer dan alleen celdeling. Zowel bij mensen als bij muizen groeien haarzakjes constant, waarbij ze oud haar afstoten en nieuw haar vormen. Stamcellen, die zich kunnen ontwikkelen tot verschillende celtypen, spelen een belangrijke rol in dit vernieuwingsproces. Eerdere studies hebben aangetoond dat KRAS-mutaties leiden tot een verhoogde proliferatie van stamcellen in haarzakjes, en deze grote toename van stamcellen werd verantwoordelijk geacht voor de precancereuze weefselaandoening.
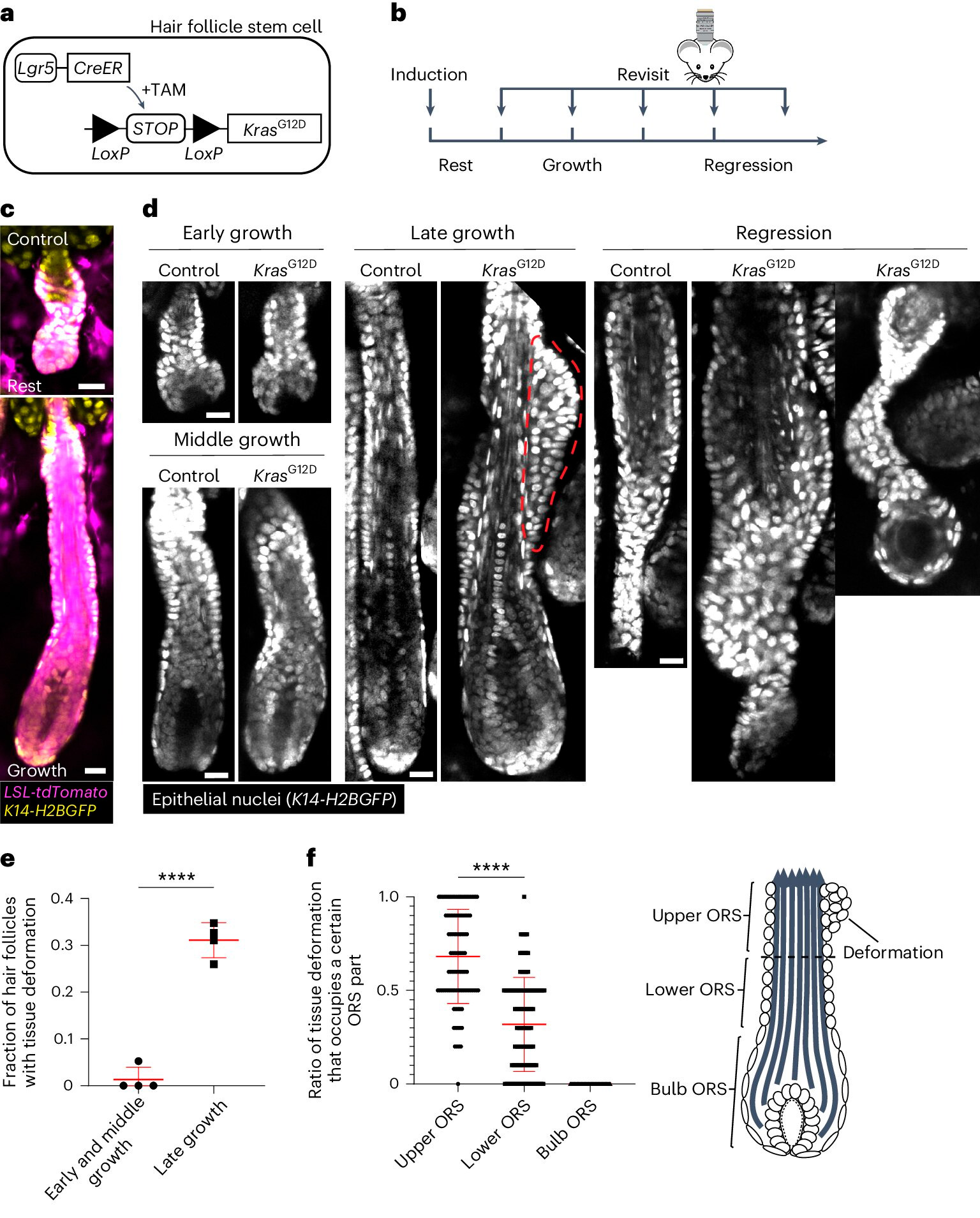
KrasG12D induceert spatiotemporeel specifieke weefselvervormingen tijdens de regeneratie van haarfollikels.
A. Schematische weergave van de genetische benadering om KrasG12D te induceren in haarfollikelstamcellen met behulp van het tamoxifen-induceerbare Cre-LoxP (TAM)-systeem.
B. Schematische weergave van de timing van KrasG12D-inductie en heropname ten opzichte van de stadia van de haarcyclus.
C. Representatieve beelden van wildtype rustende en groeiende haarfollikels die de Cre-induceerbare tdTomato (Magenta)-reporter bevatten na inductie.
D. Representatieve beelden van controle- en KrasG12D-haarfollikels in verschillende stadia van de haarcyclus. Weefselvervorming als knobbeltjes in de buitenste wortelschede (ORS) wordt aangegeven met de rode stippellijn.
E. Percentage KrasG12D-haarfollikels met weefselvervorming in verschillende stadia van de haarfollikelgroei.
F. Aandeel weefselvervormingen in de bovenste, onderste en bolvormige delen van de ORS voor individuele KrasG12D-haarzakjes.
Bron: Nature Cell Biology (2024). DOI: 10.1038/s41556-024-01413-y
Om dit idee te testen, gebruikte het team een speciaal ontwikkelde vorm van gemuteerd KRAS, dat ze op specifieke momenten in de huidcellen van de haarzakjes van de dieren konden activeren. Xin en zijn collega's gebruikten een microscopietechniek genaamd intravitale beeldvorming, waarmee in vivo hoge-resolutiebeelden van cellen kunnen worden gemaakt en individuele stamcellen in de dieren kunnen worden getagd en gevolgd.
Toen de KRAS-mutatie werd geactiveerd, begonnen alle stamcellen sneller te prolifereren, maar de precancereuze bult vormde zich alleen op één specifieke plek in de haarfollikel en tijdens één groeifase. Dit betekent dat de algehele toename in het aantal cellen waarschijnlijk niet het hele verhaal was.
Activering van de KRAS-mutatie in haarzakjes zorgde ervoor dat stamcellen sneller gingen prolifereren, hun migratiepatronen veranderden en zich in andere richtingen deelden vergeleken met cellen zonder de kankerbevorderende mutatie.
De mutatie beïnvloedt een eiwit dat bekendstaat als ERK. Xin kon de ERK-activiteit in realtime monitoren in individuele stamcellen van levende dieren en ontdekte een specifieke verandering in de activiteit van dit eiwit, veroorzaakt door de KRAS-mutatie. De onderzoekers konden de vorming van de precancereuze knobbel ook stoppen met behulp van een MEK-remmer, die de ERK-activiteit blokkeert.
Het medicijn stopte de effecten van de mutatie op celmigratie en -oriëntatie, maar niet op de algehele proliferatie van stamcellen. Dat betekent dat het ontstaan van de precancereuze aandoening wordt aangestuurd door deze eerste twee veranderingen, in plaats van door toegenomen celproliferatie.
Precancereuze veranderingen in context Het realtime volgen van de effecten van een oncogene mutatie in een levend organisme is de enige manier waarop onderzoekers deze principes hebben kunnen ontrafelen. Dit is belangrijk omdat kankers zich niet in een vacuüm vormen – ze zijn sterk afhankelijk van hun micro-omgeving om te groeien en zichzelf in stand te houden. De wetenschappers moesten niet alleen het gedrag van individuele cellen volgen, maar ook de moleculen in die cellen.
"De aanpak die we hebben gekozen om deze oncogene gebeurtenissen te begrijpen, draait in feite om het verbinden van verschillende niveaus," aldus Greco. "De structuur en benaderingen die Dr. Xin en Dr. Regot hebben gebruikt, hebben ons in staat gesteld om tot op moleculaire schaal door te dringen en deze te verbinden met cellulair en weefselniveau. Dit geeft ons een oplossing voor deze gebeurtenissen die buiten een levend organisme zo moeilijk te bereiken is."
De onderzoekers willen het proces nu over een langere periode volgen om te zien wat er gebeurt nadat de eerste uitstulping is ontstaan. Ze willen ook andere oncogene processen, zoals ontstekingen, bestuderen om te zien of de principes die ze hebben ontdekt ook in andere contexten van toepassing zijn.
