Thalidomidederivaten leiden tot de dood van resistente kankercellen
Laatst beoordeeld: 14.06.2024

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Een onderzoek uitgevoerd door Goethe-Universiteit Frankfurt wijst op de mogelijkheid dat thalidomidederivaten potentieel geschikt zijn voor de behandeling van kanker. In de jaren vijftig werd thalidomide verkocht als slaappil. Later werd het berucht vanwege het veroorzaken van ernstige misvormingen bij de foetus in de vroege stadia van de zwangerschap.
Het is ook bekend dat het molecuul eiwitten in de cel markeert voor vernietiging. Als onderdeel van het huidige onderzoek hebben wetenschappers derivaten van thalidomide gemaakt. Ze konden aantonen dat deze stoffen de vernietiging van eiwitten beïnvloeden die verantwoordelijk zijn voor het overleven van kankercellen.
Misschien heeft geen enkel ander molecuul zo'n turbulent verleden als thalidomide. Het was het hoofdbestanddeel van een medicijn dat in de jaren vijftig in veel landen werd goedgekeurd als kalmerend en hypnotiserend middel. Het werd echter al snel duidelijk dat zwangere vrouwen die thalidomide gebruikten vaak kinderen kregen met ernstige misvormingen.
De afgelopen decennia heeft de geneeskunde er echter opnieuw hoge verwachtingen van gesteld. Uit onderzoek is onder meer gebleken dat het de groei van bloedvaten remt en daardoor potentieel geschikt is om tumoren uit hun voedingsbodem af te snijden. Toen bleek het ook zeer effectief bij de behandeling van multipel myeloom, kwaadaardige tumoren in het beenmerg.
“We weten nu dat thalidomide een ‘moleculaire lijm’ kan worden genoemd”, legt Dr. Xinglai Cheng van het Instituut voor Farmaceutische Chemie van de Goethe-Universiteit in Frankfurt uit. "Dit betekent dat het twee eiwitten kan pakken en zich daaraan kan verbinden."
Dit is vooral interessant omdat een van deze eiwitten een soort "labelmachine" is: hij plakt een ondubbelzinnig "TRASH"-label aan een ander eiwit.
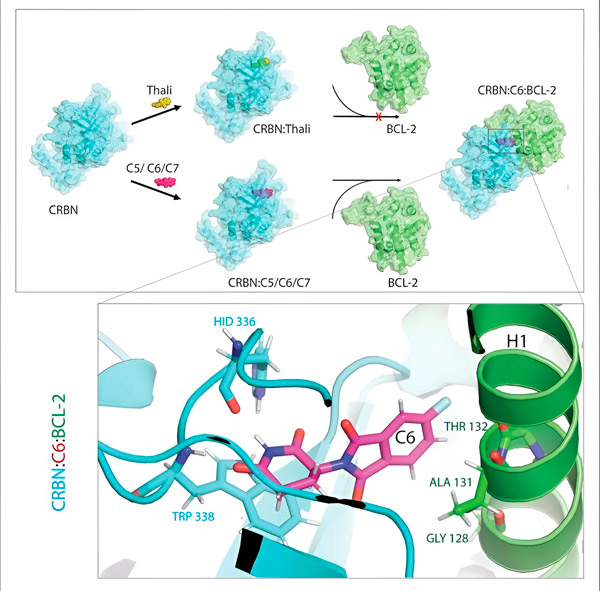
Thalidomidederivaten C5, C6 en C7 modificeren CRBN, de "labelmachine", zodat het kan binden aan BCL-2. Het BCL-2-molecuul is dus gemarkeerd voor afbraak – een mogelijke nieuwe strategie om kanker te bestrijden. Auteur: Dr. Xinglai Cheng
Het afvalverwerkingssysteem van de cel herkent deze tag: het pakt het gelabelde eiwitmolecuul en vernietigt het. "Het is dit mechanisme dat de verschillende effecten van thalidomide verklaart", zegt Cheng. "Afhankelijk van welk eiwit is getagd, kan dit leiden tot misvormingen tijdens de embryonale ontwikkeling of tot de vernietiging van kwaadaardige cellen."
Dit mechanisme biedt grote medische beloften omdat kankercellen afhankelijk zijn van bepaalde eiwitten om te overleven. Als ze systematisch zouden kunnen worden aangepakt en versnipperd, zou de ziekte kunnen worden genezen. Het probleem is dat moleculaire lijm nogal eigenaardig is.
Een van de bindingspartners is altijd een celmarkeringsmachine, of in wetenschappelijk jargon een E3-ligase genaamd CRBN. Slechts enkele van de vele duizenden eiwitten in het lichaam kunnen een tweede partner zijn – welke afhankelijk zijn van de lijm.
"Dus hebben we een reeks thalidomidederivaten gemaakt", zegt Cheng. "Vervolgens hebben we onderzocht of ze hechtende eigenschappen hadden en zo ja, tegen welke eiwitten ze effectief waren." Om dit te doen, voegden de onderzoekers hun derivaten toe aan alle eiwitten in de volwassen cellijn. Vervolgens keken ze welke van deze eiwitten vervolgens afbraken in de aanwezigheid van CRBN.
"Tijdens dit proces hebben we drie derivaten geïdentificeerd die een cellulair eiwit kunnen taggen dat erg belangrijk is voor de afbraak, BCL-2", legt Cheng uit. "BCL-2 voorkomt dat de cellen hun zelfvernietigingsprogramma activeren, dus als dit ontbreekt, sterven de cellen."
BCL-2 is daarom lange tijd het middelpunt van kankeronderzoek geweest. Er bestaat zelfs al een medicijn tegen leukemie genaamd venetoclax, dat de effectiviteit van BCL-2 vermindert en er daardoor voor zorgt dat de gemuteerde cellen zichzelf vernietigen.
"In veel kankercellen is BCL-2 zelf echter gemuteerd. Als gevolg daarvan remt venetoclax het eiwit niet langer", zegt Cheng. “We konden aantonen dat onze derivaten deze gemuteerde vorm ook markeren voor afbraak. Bovendien simuleerden onze partners van het Max Planck Instituut voor Biofysica de interactie van thalidomidederivaten met BCL-2 op de computer. Hieruit bleek dat de derivaten binden aan totaal andere locaties dan venetoclax - een resultaat dat we later ook experimenteel konden bevestigen."
Daarnaast testten de onderzoekers hun stoffen op fruitvliegjes met kankercellen. Het overlevingspercentage van op deze manier behandelde vliegen was aanzienlijk hoger. Cheng waarschuwt echter dat je niet te opgewonden raakt, omdat deze resultaten nog steeds fundamenteel onderzoek zijn. "Hoewel ze laten zien dat de gemodificeerde thalidomidemoleculen een groot therapeutisch potentieel hebben, kunnen we nog niet zeggen of ze zich ooit in de praktijk zullen bewijzen."
De onderzoeksresultaten zijn gepubliceerd in het tijdschrift Cell Reports Physical Science.
