Wetenschappers hebben een nieuw immunosuppressief mechanisme ontdekt bij hersenkanker
Laatst beoordeeld: 14.06.2024

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Universitair hoofddocent Filippo Veglia, Ph.D., en zijn team aan het Wistar Institute hebben een belangrijk mechanisme ontdekt waarmee glioblastoom—een ernstige en vaak dodelijke hersentumor—het immuunsysteem onderdrukt, zodat de tumor kan groeien zonder weerstand te ondervinden van de verdedigingsmechanismen van het lichaam.
Hun ontdekking werd gepubliceerd in het artikel "Glucose-driven histone lactylation promotes the immunosuppressive activity of monocyte-derived macrophages in glioblastoma" in Immunity.
"Ons onderzoek toont aan dat de mechanismen van zelfbehoud van kanker, indien voldoende begrepen, zeer effectief tegen de ziekte kunnen worden gebruikt," zei Dr. Veglia.
"Ik kijk uit naar toekomstig onderzoek naar de mechanismen van metabole immunosuppressie bij glioblastoom en hopen dat we meer te weten komen over hoe we deze kanker beter kunnen begrijpen en bestrijden."
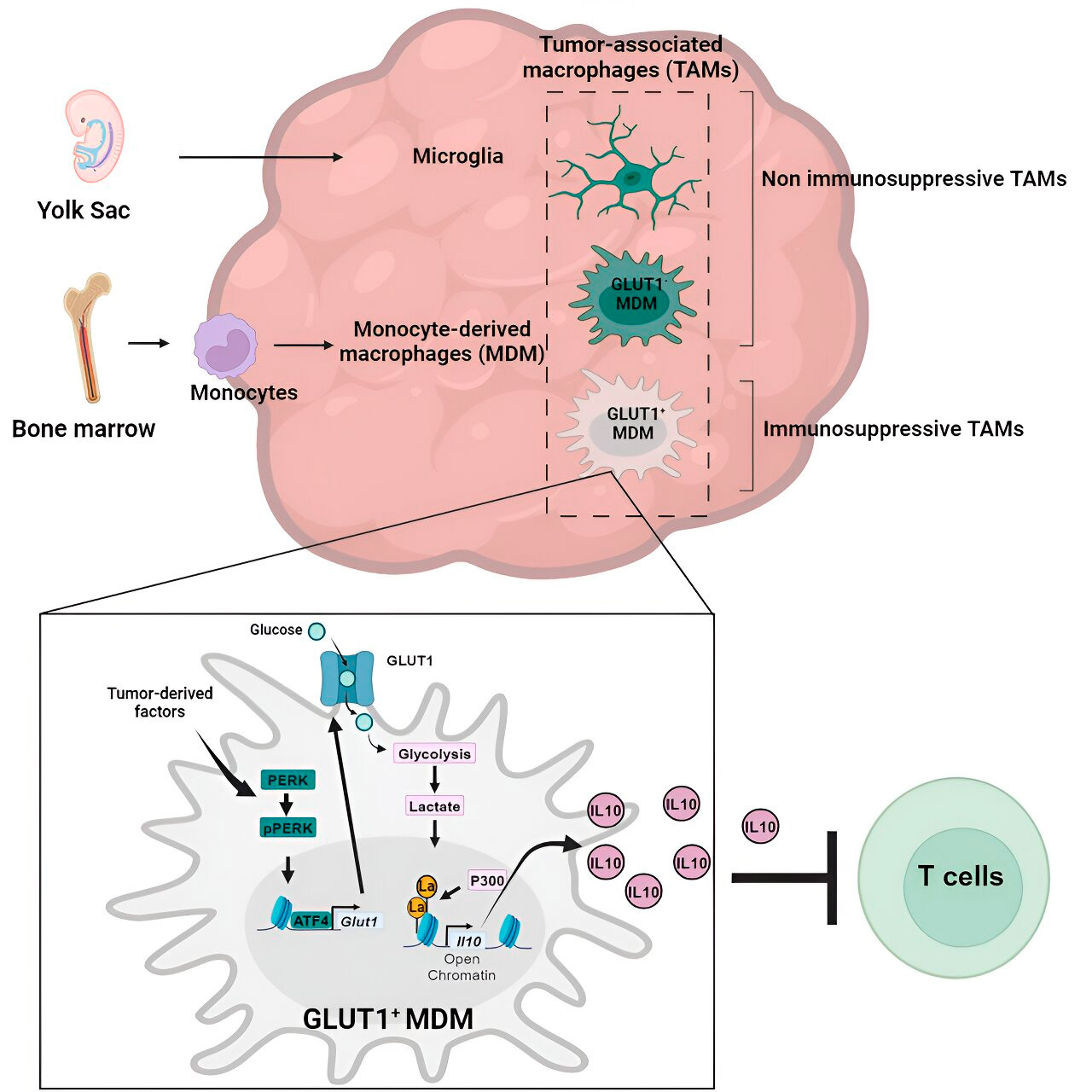
Tot nu toe is er weinig onderzocht over hoe van monocyten afkomstige macrofagen en microglia een immunosuppressieve tumormicro-omgeving creëren bij glioblastoom.
Het laboratorium van Weglia onderzocht de cellulaire mechanismen van immunosuppressie bij glioblastoom en ontdekte dat naarmate glioblastoom vordert, van monocyten afkomstige macrofagen de microglia in aantal beginnen te overtreffen, wat aangeeft dat de overheersing van van monocyten afkomstige macrofagen in de tumormicro-omgeving gunstig is voor de kanker in termen van het ontwijken van de immuunrespons.
Inderdaad, van monocyten afkomstige macrofagen, maar niet microglia, blokkeerden de activiteit van T-cellen (immuuncellen die tumorcellen vernietigen) in preklinische modellen en bij patiënten. Het team bevestigde dit door preklinische glioblastoommodellen te evalueren met kunstmatig gereduceerde aantallen monocyt-afgeleide macrofagen.
Zoals verwacht lieten modellen met minder kwaadaardige macrofagen in de tumormicro-omgeving betere resultaten zien vergeleken met standaard glioblastoommodellen.
Glioblastoom is goed voor iets meer dan de helft van alle kwaadaardige tumoren die in de hersenen ontstaan, en de prognose voor patiënten met deze ziekte is extreem slecht: slechts 25% van de patiënten overleeft het eerste jaar na de diagnose. Glioblastoom is niet alleen gevaarlijk vanwege de locatie in de hersenen, maar ook vanwege de immunosuppressieve tumormicro-omgeving, waardoor glioblastoom resistent is tegen veelbelovende immunotherapieën.
Door bepaalde immuuncellen, zoals macrofagen (van monocyten afgeleide macrofagen en microglia), te programmeren om vóór de tumor te werken in plaats van ertegen, creëert glioblastoom voor zichzelf een micro-omgeving voor de tumor waardoor de kanker agressief kan groeien en tegelijkertijd de antikanker kan ontwijken immuunreacties.
Het mechanisme ontdekken
Nadat de rol van van monocyten afkomstige macrofagen was bevestigd, probeerde het laboratorium van Weglia vervolgens precies te begrijpen hoe deze kankergeassocieerde immuuncellen precies tegen het immuunsysteem werken.
Ze bepaalden de sequentie van macrofagen om te bepalen of de cellen abnormale genexpressiepatronen hadden die zouden kunnen wijzen op genen die een rol spelen bij immuunsuppressie, en onderzochten ook de metabolische patronen van macrofagen om te begrijpen of abnormale genexpressie verband hield met de stofwisseling.
>Gen- en metabolismeanalyse leidde hen naar het glucosemetabolisme. Een reeks tests toonde aan dat van monocyten afkomstige macrofagen met een verhoogd glucosemetabolisme en expressie van GLUT1, de belangrijkste glucosetransporter, de T-celfunctie blokkeerden door interleukine-10 (IL-10) vrij te geven.
Het team heeft aangetoond dat glioblastoom het glucosemetabolisme in deze macrofagen verstoort, waardoor ze immunosuppressief worden.
Histone-lactylering en zijn rol
Onderzoekers hebben ontdekt dat de sleutel tot de immunosuppressieve activiteit van van monocyten afkomstige macrofagen die verband houden met het glucosemetabolisme ligt in een proces dat ‘histonlactylering’ wordt genoemd. Histonen zijn structurele eiwitten in het genoom die in bepaalde contexten een sleutelrol spelen bij de expressie van genen zoals IL-10.
Door glucose snel te metaboliseren, produceren van monocyten afkomstige macrofagen lactaat, een bijproduct van het glucosemetabolisme. Histonen kunnen 'gelactyleerd' worden (dat wil zeggen dat lactaat in de histonen wordt geïntegreerd), zodat de histonorganisatie de expressie van IL-10 bevordert, dat wordt geproduceerd door van monocyten afkomstige macrofagen om de groei van kankercellen te ondersteunen.
Probleemoplossing
Maar hoe kun je de immunosuppressieve activiteit van van monocyten afkomstige macrofagen die verband houden met het glucosemetabolisme stoppen? Dr. Veglia en zijn team identificeerden een mogelijke oplossing: PERK, een enzym dat zij identificeerden als een regulator van het glucosemetabolisme en de GLUT1-expressie in macrofagen.
In preklinische modellen van glioblastoom verstoorde het richten op PERK de lactylatie van histonen en de immunosuppressieve activiteit van macrofagen, en in combinatie met immunotherapie blokkeerde het de progressie van glioblastoom en induceerde het langdurige immuniteit die de hersenen beschermde tegen hergroei van tumoren, wat suggereert dat het richten op PERK-histone lactylatie-as kan een haalbare strategie zijn om deze dodelijke hersenkanker te bestrijden.
