Nieuwe publicaties
Gesloten afgiftesysteem voor medicijnen kan toediening van chemotherapie verbeteren
Last reviewed: 02.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Wanneer kankerpatiënten chemotherapie ondergaan, wordt de dosis van de meeste medicijnen berekend op basis van het lichaamsoppervlak van de patiënt. Dit wordt geschat met behulp van een vergelijking die rekening houdt met de lengte en het gewicht van de patiënt. Deze vergelijking werd in 1916 opgesteld op basis van gegevens van slechts negen patiënten.
Deze vereenvoudigde doseringsaanpak houdt geen rekening met andere factoren en kan ertoe leiden dat een patiënt te veel of te weinig van een medicijn krijgt. Hierdoor kunnen sommige patiënten onnodige toxiciteit of onvoldoende effectiviteit ervaren van de chemotherapie die ze krijgen.
Om de nauwkeurigheid van chemotherapiedosering te verbeteren, hebben MIT-ingenieurs een alternatieve aanpak ontwikkeld waarmee de dosering voor elke patiënt gepersonaliseerd kan worden. Hun systeem meet de hoeveelheid medicijn in het lichaam van de patiënt en voert die gegevens in een controller in die de infusiesnelheid dienovereenkomstig kan aanpassen.
Volgens de onderzoekers zou deze aanpak kunnen helpen om verschillen in de farmacokinetiek van geneesmiddelen te compenseren die worden veroorzaakt door lichaamssamenstelling, genetische aanleg, door chemotherapie veroorzaakte orgaantoxiciteit, interacties met andere geneesmiddelen en voeding, en circadiaanse variaties in de enzymen die verantwoordelijk zijn voor de afbraak van chemotherapiemedicijnen.
"Doordat we de vooruitgang in het inzicht in hoe geneesmiddelen worden gemetaboliseerd erkennen en technische hulpmiddelen toepassen om gepersonaliseerde dosering te vereenvoudigen, geloven we dat we de veiligheid en effectiviteit van veel geneesmiddelen kunnen verbeteren", aldus Giovanni Traverso, universitair hoofddocent werktuigbouwkunde aan het MIT, gastro-enteroloog bij Brigham and Women's Hospital en hoofdauteur van de studie.
Louis DeRidder, een doctoraalstudent aan het MIT, is de hoofdauteur van het artikel gepubliceerd in het tijdschrift Med.
Continue monitoring
In deze studie richtten de onderzoekers zich op een medicijn genaamd 5-fluorouracil, dat wordt gebruikt voor de behandeling van colorectale kanker en andere vormen van kanker. Het medicijn wordt doorgaans toegediend gedurende een periode van 46 uur en de dosering wordt bepaald met behulp van een formule op basis van de lengte en het gewicht van de patiënt, wat een schatting geeft van het lichaamsoppervlak.
Deze aanpak houdt echter geen rekening met verschillen in lichaamssamenstelling die van invloed kunnen zijn op de distributie van het medicijn in het lichaam, of genetische variaties die van invloed zijn op de metabolisatie ervan. Deze verschillen kunnen leiden tot schadelijke bijwerkingen als er te veel van het medicijn wordt toegediend. Als er te weinig van het medicijn wordt toegediend, is het mogelijk dat het de tumor niet doodt zoals verwacht.
"Mensen met hetzelfde lichaamsoppervlak kunnen heel verschillende lengtes en gewichten hebben, verschillende spiermassa's of verschillende genen, maar zolang de lengte en het gewicht in die vergelijking hetzelfde lichaamsoppervlak opleveren, is hun dosis identiek", aldus DeRidder, een promovendus in het programma medische technologie en medische fysica aan het Harvard-MIT Program in Health Sciences and Technology.
Een andere factor die de hoeveelheid geneesmiddel in het bloed op elk moment kan veranderen, is de circadiane variatie in het enzym dihydropyrimidine dehydrogenase (DPD), dat 5-fluorouracil afbreekt. De expressie van DPD wordt, net als veel andere enzymen in het lichaam, gereguleerd door een circadiane ritme. De afbraak van 5-FU door DPD is dus niet constant, maar varieert met het tijdstip van de dag. Deze circadiane ritmes kunnen leiden tot een tienvoudige variatie in de hoeveelheid 5-FU in het bloed van een patiënt tijdens een infuus.
"Door het lichaamsoppervlak te gebruiken om de chemotherapiedosis te berekenen, weten we dat twee mensen zeer verschillende bijwerkingen van 5-fluorouracil kunnen ervaren. De ene patiënt kan behandelcycli hebben met minimale bijwerkingen, en dan weer een cyclus met ernstige bijwerkingen. Er is iets veranderd in de manier waarop de patiënt de chemotherapie verwerkte, van de ene cyclus naar de andere. Onze verouderde doseringsmethode houdt geen rekening met deze veranderingen, en patiënten lijden eronder", zegt Douglas Rubinson, klinisch oncoloog bij het Dana-Farber Cancer Institute en een van de auteurs van het artikel.
Een manier om de variabiliteit in de farmacokinetiek van chemotherapie te compenseren, is een strategie genaamd therapeutische geneesmiddelmonitoring. Hierbij geeft de patiënt aan het einde van een behandelcyclus een bloedmonster. Nadat dit bloedmonster is geanalyseerd op de geneesmiddelconcentratie, kan de dosering indien nodig worden aangepast aan het begin van de volgende cyclus (meestal twee weken voor 5-fluorouracil).
Er is aangetoond dat deze aanpak leidt tot betere resultaten voor patiënten, maar deze wordt niet op grote schaal gebruikt voor chemotherapieën zoals 5-fluorouracil.
De MIT-onderzoekers wilden een vergelijkbaar type monitoring ontwikkelen, maar dan op een geautomatiseerde manier. Daarmee zou de dosering van medicijnen in real time gepersonaliseerd kunnen worden, wat tot betere resultaten voor patiënten zou kunnen leiden.
In het gesloten systeem kunnen de medicijnconcentraties continu worden bewaakt. Deze informatie wordt gebruikt om de infusiesnelheid van het chemotherapiemedicijn automatisch aan te passen, zodat de dosis binnen het streefbereik blijft.
Dankzij dit gesloten systeem kan de dosering van medicijnen worden gepersonaliseerd. Hierbij wordt rekening gehouden met de circadiane ritmes van de enzymniveaus die medicijnen metaboliseren, en met eventuele veranderingen in de farmacokinetiek van de patiënt sinds de laatste behandeling, zoals door chemotherapie veroorzaakte orgaantoxiciteit.
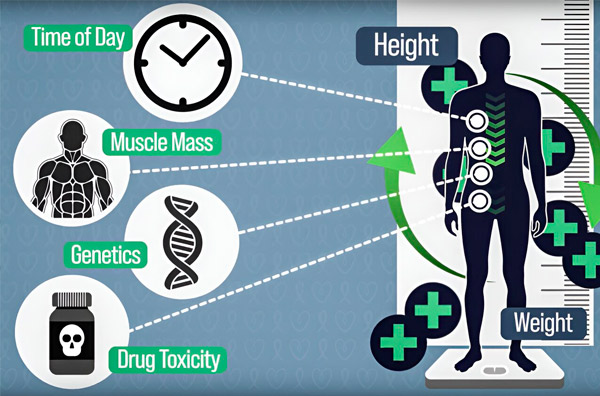
Om de dosering van chemotherapie nauwkeuriger te maken, hebben MIT-ingenieurs een manier ontwikkeld om de hoeveelheid medicijn in het lichaam van een patiënt continu te meten tijdens een infuus van meerdere uren. Dit helpt om verschillen te compenseren die worden veroorzaakt door lichaamssamenstelling, genetica, medicijntoxiciteit en circadiane oscillaties. Bron: Met dank aan de onderzoekers.
Het nieuwe systeem dat de onderzoekers hebben ontwikkeld, CLAUDIA (Closed-Loop AUtomated Drug Infusion regulAtor), maakt voor elke stap gebruik van commercieel verkrijgbare apparatuur. Bloedmonsters worden elke vijf minuten afgenomen en snel voorbereid voor analyse. De concentratie 5-fluorouracil in het bloed wordt gemeten en vergeleken met de streefwaarden.
Het verschil tussen de doelconcentratie en de gemeten concentratie wordt ingevoerd in een controlealgoritme, dat vervolgens de infusiesnelheid indien nodig aanpast om de dosis binnen het concentratiebereik te houden waarbij het medicijn effectief en niet-toxisch is.
"We hebben een systeem ontwikkeld waarmee we de medicijnconcentratie continu kunnen meten en de infusiesnelheid indien nodig kunnen aanpassen om de medicijnconcentratie binnen het therapeutische venster te houden", aldus DeRidder.
Snelle aanpassing
Bij dierproeven ontdekten de onderzoekers dat ze met behulp van CLAUDIA de hoeveelheid medicijn die in het lichaam circuleerde, ongeveer 45 procent van de tijd binnen het gewenste bereik konden houden.
De medicijnspiegels bij dieren die chemotherapie zonder CLAUDIA kregen, bleven gemiddeld slechts 13 procent van de tijd binnen het streefbereik. De onderzoekers hebben de effectiviteit van de medicijnspiegels in deze studie niet getest, maar het handhaven van de concentraties binnen het streefbereik zou naar verwachting leiden tot betere resultaten en minder toxiciteit.
CLAUDIA kon de dosis 5-fluorouracil ook binnen het streefbereik houden, zelfs wanneer een geneesmiddel werd toegediend dat het DPD-enzym remt. Bij dieren die deze remmer kregen zonder continue monitoring en aanpassing, stegen de 5-fluorouracilspiegels tot wel acht keer zo hoog.
Voor deze demonstratie voerden de onderzoekers elke stap van het proces handmatig uit met behulp van standaardapparatuur. Nu zijn ze van plan om elke stap te automatiseren, zodat controle en dosisaanpassingen zonder menselijke tussenkomst kunnen worden uitgevoerd.
Om de medicijnconcentraties te meten, maakten de onderzoekers gebruik van hogeprestatievloeistofchromatografie-massaspectrometrie (HPLC-MS), een techniek die kan worden aangepast om vrijwel elk type medicijn te detecteren.
"Wij voorzien een toekomst waarin we CLAUDIA kunnen gebruiken voor elk medicijn dat de juiste farmacokinetische eigenschappen heeft en detecteerbaar is via HPLC-MS, waardoor gepersonaliseerde dosering voor veel verschillende medicijnen mogelijk wordt", aldus DeRidder.
