Medisch expert van het artikel
Nieuwe publicaties
Habituele miskraam - Oorzaken
Laatst beoordeeld: 04.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
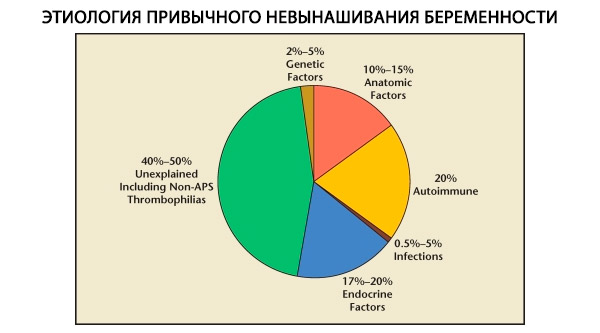
In de structuur van habituele miskramen worden genetische, anatomische, endocriene, immunologische en infectieuze factoren onderscheiden. Wanneer alle bovengenoemde oorzaken worden uitgesloten, blijft er een groep patiënten over bij wie de oorzaak van de habituele miskraam onduidelijk is (idiopathische miskramen). Volgens C. Coulam et al. (1996) is 80% van de idiopathische miskramen gebaseerd op niet-herkende immuunstoornissen.
Er is geen overtuigend bewijs dat endometriose herhaalde miskramen veroorzaakt, of dat medische of chirurgische behandeling van endometriose de incidentie van herhaalde miskramen vermindert.
Volgens de huidige inzichten leiden, naast genetische en deels infectieuze oorzaken die leiden tot de vorming van een abnormaal embryo, de schadelijke effecten van andere factoren (anatomische, endocriene, immunologische) tot het creëren van een ongunstige omgeving voor de ontwikkeling van een genetisch complete bevruchte eicel, wat leidt tot uitputting van de reservecapaciteit van het chorion en het stoppen van de ontwikkeling (embryogenese). Kritieke periodes in het eerste trimester van de zwangerschap worden erkend als 6-8 weken (dood van het embryo) en 10-12 weken (uitstoting van de bevruchte eicel).
 [ 1 ]
[ 1 ]
Genetische oorzaken van een miskraam
Genetische factoren zijn verantwoordelijk voor 3-6% van de oorzaken van een miskraam. Bij sporadische zwangerschapsafbreking in het eerste trimester heeft ongeveer 50% van de abortussen chromosomale afwijkingen. De meeste daarvan (95%) zijn veranderingen in het aantal chromosomen - monosomie (verlies van één chromosoom) en trisomie (de aanwezigheid van een extra chromosoom), die het gevolg zijn van fouten in de meiose, en polyploïdie (een toename van de chromosomensamenstelling met een volledige haploïde set), die optreedt wanneer een eicel door twee of meer zaadcellen wordt bevrucht. Bij sporadische miskramen komt trisomie het vaakst voor: 60% van alle mutaties (meestal op chromosoom 16, maar ook op chromosoom 13, 18, 21, 22). Qua frequentie staat het Shereshevsky-Turnersyndroom (chromosoom 45 X0) op de tweede plaats: 20%. De resterende 15% wordt veroorzaakt door polyploïdie (vooral triploïdie).
In het geval van een verandering in het aantal chromosomen bij een abortus, brengt onderzoek van het karyotype van de ouders meestal geen pathologie aan het licht en is de kans op een chromosomale aandoening van de foetus tijdens een volgende zwangerschap 1%. Daarentegen worden bij onderzoek van abortussen bij paren met een habituele miskraam in 3-6% van de gevallen structurele veranderingen in chromosomen (intra- en interchromosomaal) waargenomen. Bij onderzoek van het karyotype van de ouders worden in 7% van de gevallen evenwichtige chromosomale herschikkingen gevonden. Meestal gaat het hierbij om reciproke translocaties, waarbij een segment van één chromosoom zich op de plaats van een ander segment van een niet-homoloog chromosoom bevindt, evenals mozaïcisme van geslachtschromosomen, inversie en detectie van chromosomen in de vorm van een ring. In het geval van de aanwezigheid van dergelijke herschikkingen bij een van de partners, worden de processen van paring en scheiding van chromosomen tijdens de meiose belemmerd, wat resulteert in het verlies (deletie) of verdubbeling (duplicatie) van chromosoomdelen in de gameten. Dit resulteert in zogenaamde ongebalanceerde chromosomale herschikkingen, waarbij het embryo ofwel niet-levensvatbaar is ofwel drager is van een ernstige chromosomale pathologie. De kans op een kind met ongebalanceerde chromosomale afwijkingen bij aanwezigheid van gebalanceerde chromosomale herschikkingen in het karyotype van een van de ouders bedraagt 1-15%. Verschillen in de gegevens hangen samen met de aard van de herschikkingen, de grootte van de betrokken segmenten, het geslacht van de drager en de familiegeschiedenis.
Diagnostiek
Anamnese
- Erfelijke ziekten bij familieleden.
- Aanwezigheid van aangeboren afwijkingen in de familie.
- Geboorte van kinderen met een verstandelijke beperking.
- De aanwezigheid van onvruchtbaarheid en/of een miskraam van onbekende oorzaak bij een echtpaar of bij familieleden.
- Aanwezigheid van onduidelijke gevallen van perinatale sterfte.
Speciale onderzoeksmethoden
- Onderzoek naar het karyotype van de ouders is vooral geïndiceerd bij gehuwde stellen bij de geboorte van een pasgeborene met ontwikkelingsstoornissen en een voorgeschiedenis van miskramen, evenals bij herhaalde miskramen in de vroege stadia van de zwangerschap.
- Cytogenetische analyse van abortus in geval van doodgeboorte of neonatale sterfte.
Indicaties voor overleg met andere specialisten
Indien er bij de ouders veranderingen in het karyotype worden vastgesteld, is het noodzakelijk om een geneticus te raadplegen. Deze kan beoordelen hoe groot het risico is dat er een kind met een pathologie ontstaat of, indien nodig, beslissen of er een eicel- of spermadonatie moet plaatsvinden.
Verdere behandeling van de patiënt
Als er bij een echtpaar een pathologisch karyotype is, zelfs bij één van de ouders, wordt aangeraden om tijdens de zwangerschap prenatale diagnostiek uit te voeren - chorionbiopsie of vruchtwaterpunctie - vanwege het hoge risico op ontwikkelingsstoornissen bij de foetus.
Anatomische oorzaken van een gewoonte-miskraam
Anatomische oorzaken van een gewoonte-miskraam zijn onder meer:
- aangeboren afwijkingen in de ontwikkeling van de baarmoeder (volledige verdubbeling van de baarmoeder; bicornuate, zadelvormige, unicorniate baarmoeder; gedeeltelijk of volledig intra-uterien septum);
- verworven anatomische afwijkingen;
- intra-uteriene verklevingen (syndroom van Asherman);
- submuceuze baarmoederfibromen;
- isthmisch-cervicale insufficiëntie.
De frequentie van anatomische afwijkingen bij patiënten met een habituele miskraam varieert van 10 tot 16%. De frequentie van baarmoedermisvormingen die kunnen leiden tot een miskraam (maar geen onvruchtbaarheid) ten opzichte van alle baarmoedermisvormingen is als volgt: bicornuate uterus - 37%, zadelvormige uterus - 15%, intra-uterien septum - 22%, volledige verdubbeling van de uterus - 11%, unicorniate uterus - 4,4%.
Diagnose van een gewoonte-miskraam
Anamnese
Bij een anatomische afwijking van de baarmoeder komen late zwangerschapsafbrekingen en vroeggeboortes vaker voor, maar bij implantatie op het intra-uteriene septum of in de buurt van de myomatische knoop zijn ook vroege zwangerschapsafbrekingen mogelijk.
Bij isthmisch-cervicale insufficiëntie is het pathognomonische teken een spontane zwangerschapsafbreking in het tweede trimester of een vroeggeboorte, wat relatief snel en met weinig pijn gebeurt.
Bij misvormingen van de baarmoeder moet men letten op anamnestische indicaties van pathologie van de urinewegen (vaak gepaard gaand met aangeboren afwijkingen van de baarmoeder) en op de aard van de ontwikkeling van de menstruatiefunctie (indicaties van hematometra met een functionerende rudimentaire hoorn van de baarmoeder).
Speciale onderzoeksmethoden
- Tegenwoordig wordt hysterosalpingografie uitgevoerd om een diagnose te stellen. Hiermee kan de vorm van de baarmoederholte worden bestudeerd, de aanwezigheid van submuceuze myomen, verklevingen en septa worden vastgesteld en de doorgankelijkheid van de eileiders worden bepaald. Om uteriene pathologie te diagnosticeren, is het zinvol om hysterosalpingografie uit te voeren in de periode tussen de menstruatie en de ovulatie, d.w.z. in de eerste fase van de menstruatiecyclus na het stoppen van de bloederige afscheiding (7-9e dag van de cyclus). Om isthmisch-cervicale insufficiëntie te diagnosticeren, wordt het onderzoek uitgevoerd in de tweede fase van de menstruatiecyclus (18-20e dag) om de toestand van de baarmoederhals te bepalen. Voordat hysterosalpingografie wordt uitgevoerd, is het noodzakelijk om ontstekingsziekten van de bekkenorganen uit te sluiten of te behandelen.
- Hysteroscopie is de laatste jaren wijdverbreid en is uitgegroeid tot de gouden standaard voor het diagnosticeren van intra-uteriene pathologie. Vanwege de hogere kosten in vergelijking met hysterosalpingografie wordt de methode echter gebruikt bij vrouwen met een indicatie voor intra-uteriene pathologie op basis van voorlopige echografiegegevens. Hysteroscopie kan worden gebruikt om de baarmoederholte te onderzoeken, de aard van de intra-uteriene pathologie te bepalen en, indien de benodigde apparatuur (resectoscoop) beschikbaar is, minimaal invasieve chirurgische behandeling uit te voeren - verwijdering van verklevingen, submukeuze myoomklieren en endometriumpoliepen. Bij het verwijderen van een intra-uterien septum wordt de voorkeur gegeven aan hysteroresectoscopie met laparoscopische controle, wat perforatie van de baarmoederwand voorkomt.
- Echografie wordt uitgevoerd in de eerste fase van de menstruatiecyclus, wat een vermoedelijke diagnose van submukeuze uterusmyomen en intra-uteriene verklevingen mogelijk maakt, en in de tweede fase van de cyclus om een intra-uterien septum en een bicornuate uterus te identificeren. Deze methode is met name van belang in de vroege stadia van de zwangerschap, wanneer de sensitiviteit bij het diagnosticeren van deze aandoeningen 100% is en de specificiteit 80%. Buiten de zwangerschap vereist de diagnose aanvullende bevestiging met andere methoden.
- Buitenlandse auteurs wijzen op het voordeel van sonohysterografie (echografie met behulp van een transvaginale sensor met voorafgaande inbrenging van een 0,9% natriumchlorideoplossing in de baarmoederholte) ten opzichte van hysterosalpingografie, omdat het differentiële diagnostiek mogelijk maakt tussen het intra-uteriene septum en de bicornuate uterus. Met sonohysterografie is het niet alleen mogelijk om de vorm van de baarmoederholte te bestuderen, maar ook om de configuratie van de fundus van het baarmoederlichaam te bepalen. In ons land is deze methode niet wijdverbreid.
- In sommige complexe gevallen wordt MRI van de bekkenorganen gebruikt om de diagnose te verifiëren. Deze methode maakt het mogelijk waardevolle informatie te verkrijgen in geval van afwijkingen in de ontwikkeling van de baarmoeder, gepaard gaande met een atypische rangschikking van organen in het bekken. MRI is belangrijk bij een rudimentaire baarmoederhoorn om te beslissen of verwijdering ervan wenselijk is. Verwijdering van de rudimentaire baarmoederhoorn is noodzakelijk wanneer deze verbonden is met de eileider en de eierstok, om de vorming en ontwikkeling van de bevruchte eicel daarin te voorkomen. Zwangerschapsafbreking bij anatomische afwijkingen van de baarmoeder kan gepaard gaan met een mislukte innesteling van de bevruchte eicel (op het intra-uteriene septum, nabij de submukeuze myoomknoop), onvoldoende ontwikkelde vascularisatie en ontvangst van het endometrium, nauwe ruimtelijke relaties in de baarmoederholte (bijvoorbeeld in geval van holtevervorming door een myoomknoop), vaak gepaard gaande met intra-uteriene occlusie (ICI), en hormonale stoornissen.
Behandeling van een miskraam
Chirurgische behandeling
Bij aanwezigheid van een intra-uterien septum, submukeuze myoomklieren en verklevingen is hysteroresectoscopie de meest effectieve chirurgische behandeling. De frequentie van volgende miskramen bij deze groep vrouwen na de behandeling is 10%, vergeleken met 90% vóór de operatie. Bij vergelijking van de resultaten van laparotomie en transcervicale hysteroresectoscopie met metroplastiek, verkreeg P. Heinonen (1997) resultaten die wezen op minder trauma en een grotere effectiviteit van hysteroresectoscopie; het percentage zwangerschappen dat resulteerde in de geboorte van levensvatbare kinderen bedroeg respectievelijk 68 en 86%.
Chirurgische verwijdering van het intra-uteriene septum, verklevingen en submukeuze myoomklieren voorkomt een miskraam in 70-80% van de gevallen. Het is echter niet effectief bij vrouwen met baarmoedermisvormingen die een normale bevalling hebben gehad met daaropvolgende herhaalde miskramen. Het is waarschijnlijk dat in dergelijke gevallen de anatomische factor niet de belangrijkste oorzaak is en dat er naar andere oorzaken van een miskraam moet worden gezocht.
Het is bewezen dat abdominale metroplastiek gepaard gaat met een aanzienlijk risico op postoperatieve onvruchtbaarheid en de prognose van een volgende zwangerschap niet verbetert. Daarom is het beter om de voorkeur te geven aan hysteroscopie en laparoscopische operaties.
Medicamenteuze behandeling
De effectiviteit van het inbrengen van het spiraaltje, hoge doses oestrogene medicijnen, het inbrengen van een Foley-katheter in de baarmoederholte na operaties om verklevingen te verwijderen, intra-uterien septum is niet bewezen. Het wordt aanbevolen om een zwangerschap niet eerder dan 3 maanden na de operatie te plannen. Om de groei van het endometrium te verbeteren, wordt cyclische hormoontherapie uitgevoerd gedurende 3 menstruatiecycli [14]. Gedurende 3 maanden in de eerste 14 dagen van de cyclus, is het raadzaam om een medicijn te nemen dat 2 mg 17-bèta-estradiol bevat, in de volgende 14 dagen - 2 mg 17-bèta-estradiol en 20 mg dydrogesteron (10 mg dydrogesteron als onderdeel van een combinatiemedicijn plus 10 mg dydrogesteron in een aparte tabletvorm).
Verdere behandeling van de patiënt
Kenmerken van het verloop van de zwangerschap bij een bicornuate baarmoeder of een verdubbeling van de baarmoeder (wanneer er 2 baarmoederholtes zijn):
- in de vroege stadia van de zwangerschap treedt er vaak bloeding op uit de "lege" hoorn of baarmoederholte als gevolg van een uitgesproken deciduale reactie; de tactiek in dit geval moet conservatief zijn en bestaan uit het gebruik van krampstillende en hemostatische middelen;
- dreiging van zwangerschapsafbreking in verschillende stadia;
- ontwikkeling van isthmisch-cervicale insufficiëntie;
- intra-uteriene groeivertraging als gevolg van placenta-insufficiëntie.
In de vroege stadia van de zwangerschap wordt bij bloedingen bedrust en halfbedrust aangeraden, evenals het toedienen van hemostatische, krampstillende en kalmerende medicijnen en een behandeling met gestagenen (dydrogesteron in een dagelijkse dosis van 20 tot 40 mg) tot de 16e tot 18e week van de zwangerschap.
Endocriene oorzaken van een gewoonte-miskraam
Volgens verschillende auteurs zijn endocriene oorzaken van een miskraam verantwoordelijk voor 8 tot 20% van de gevallen. De belangrijkste hiervan zijn luteale fasedeficiëntie (LPD), hypersecretie van LH, schildklierdisfunctie en diabetes mellitus.
Ernstige schildklieraandoeningen of diabetes mellitus kunnen leiden tot herhaalde miskramen. Bij gecompenseerde diabetes mellitus verschilt het risico op herhaalde miskramen echter niet van dat bij de algemene bevolking.
Tegelijkertijd vereist de hoge incidentie van hypothyreoïdie in de bevolking screening met TSH-meting. Bij patiënten met een habituele miskraam wordt luteale fase-insufficiëntie waargenomen in 20-60% van de gevallen, en echografische tekenen van polycysteuze ovaria in 44-56%. Volgens de literatuur blijft de invloed van individuele hormonale stoornissen op de vorming van het symptomencomplex van een habituele miskraam controversieel. De studies van M. Ogasawara et al. (1997) lieten geen betrouwbare verschillen zien in de frequentie van zwangerschapsafbreking met en zonder LPI bij patiënten met twee of meer eerdere miskramen in de anamnese, waarbij auto-immuun-, anatomische en infectieuze oorzaken werden uitgesloten.
Een onvoldoende functie van het corpus luteum kan het gevolg zijn van een aantal ongunstige factoren:
- verstoringen in de afscheiding van FSH en LH in de eerste fase van de menstruatiecyclus;
- een te vroege of juist een te late piek van de LH-afgifte;
- hypo-oestrogeenisme als gevolg van inadequate folliculogenese. Al deze aandoeningen kunnen niet worden gecorrigeerd door substitutietherapie met gestageengeneesmiddelen in de postovulatoire periode. Prospectieve studies uitgevoerd door L. Regan et al. toonden een significante toename van de frequentie van miskramen bij patiënten met LH-hypersecretie op de 8e dag van de menstruatiecyclus in vergelijking met vrouwen met normale LH-bloedspiegels (respectievelijk 65% en 12% van de miskramen). Het schadelijke effect van een vroegtijdige LH-piek wordt geassocieerd met een voortijdige hervatting van de tweede meiotische deling en ovulatie van een onrijpe eicel, evenals met de inductie van androgeenproductie door thecacellen samen met een verminderde endometriumreceptie onder invloed van gestageeninsufficiëntie. Een voorlopige verlaging van de preovulatoire LH-spiegels met gonadotropine-releasing hormone agonisten zonder aanvullende maatregelen gericht op het verlengen van de daaropvolgende zwangerschap, zorgt echter niet voor de verwachte verlaging van de frequentie van miskramen.
De gouden standaard voor het diagnosticeren van NLF is histologisch onderzoek van materiaal verkregen uit een endometriumbiopsie in de tweede fase van de cyclus, gedurende 2 menstruatiecycli.
De diagnose van andere oorzaken van ovulatoire disfunctie, zoals hyperprolactinemie, hypothyreoïdie, functionele overmaat aan androgenen (ovarium- of bijnierschorshormoon), moet gepaard gaan met het voorschrijven van een passende behandeling.
Diagnostiek
Anamnese en lichamelijk onderzoek
- Anamnese. Factoren om te overwegen: late menarche, onregelmatige menstruatiecyclus (oligomenorroe, amenorroe, plotselinge gewichtstoename, gewichtsverlies, onvruchtbaarheid, herhaaldelijke vroege miskramen).
- Onderzoek: lichaamsbouw, lengte, lichaamsgewicht, hirsutisme, ernst van de secundaire geslachtskenmerken, aanwezigheid van striae, onderzoek van de borstklieren op galactorroe.
- Functionele diagnostische tests: meting van de rectale temperatuur gedurende 3 menstruatiecycli.
Speciale onderzoeksmethoden
- Hormonale studie:
- in de 1e fase van de menstruatiecyclus (7-8e dag) – bepaling van het gehalte aan FSH, LH, prolactine, TSH, testosteron, 17-hydroxyprogesteron (17-OP), DHEAS;
- in de 2e fase van de menstruatiecyclus (21–22 dagen) – bepaling van het progesterongehalte (normatieve indicatoren van het progesterongehalte zijn zeer variabel, de methode kan niet worden gebruikt zonder rekening te houden met andere factoren).
- Echografie:
- in de 1e fase van de menstruatiecyclus (5e-7e dag) – diagnose van endometriumpathologie, polycysteuze eierstokken;
- in de 2e fase van de menstruatiecyclus (20–21 dagen) – meting van de dikte van het baarmoederslijmvlies (normaal 10–11 mm, correleert met het progesterongehalte).
- Een endometriumbiopsie ter verificatie van NLF wordt 2 dagen vóór de verwachte menstruatie uitgevoerd (op de 26e dag bij een cyclus van 28 dagen). Deze methode wordt gebruikt bij onduidelijke diagnoses. Om veranderingen in het endometrium in de zogenaamde "implantatieperiode" te onderzoeken, wordt een biopsie uitgevoerd op de 6e dag na de ovulatie.
Behandeling
Bij het diagnosticeren van NLF (volgens rectale temperatuurgrafieken is de duur van de 2e fase minder dan 11 dagen, wordt een stapsgewijze temperatuurstijging waargenomen, onvoldoende secretoire transformatie van het endometrium volgens endometriumbiopsiegegevens, lage progesteronspiegels in het bloedserum) is het noodzakelijk om de oorzaak van dergelijke aandoeningen te identificeren.
Als NLF gepaard gaat met hyperprolactinemie, wordt een MRI van de hersenen uitgevoerd. Een alternatieve methode is een röntgenfoto van de schedel (regio van de Sella Turcica).
De eerste fase van hyperprolactinemie is het uitsluiten van een hypofyseadenoom, waarvoor chirurgische behandeling noodzakelijk is. Bij afwezigheid van significante veranderingen wordt hyperprolactinemie als functioneel beschouwd en wordt een behandeling met bromocriptine voorgeschreven om de prolactinespiegel te normaliseren. De aanvangsdosis bromocriptine is 1,25 mg/dag gedurende 2 weken. Na controle van de prolactinespiegel wordt de dosis verhoogd tot 2,5 mg/dag indien de indicatoren niet normaliseren. Bij een significante stijging van de prolactinespiegel is de aanvangsdosis 2,5 mg/dag. Bij zwangerschap dient de behandeling met bromocriptine te worden gestaakt.
Indien hypothyreoïdie wordt vastgesteld, wordt de aard van de schildklieraandoening in overleg met een endocrinoloog vastgesteld. In ieder geval is dagelijkse behandeling met natriumlevothyroxine geïndiceerd; de dosering wordt individueel bepaald totdat de TSH-spiegel is genormaliseerd. Indien zwangerschap optreedt, dient de behandeling met natriumlevothyroxine te worden voortgezet. De vraag of het raadzaam is de dosis in het eerste trimester van de zwangerschap te verhogen, wordt in overleg met een endocrinoloog beoordeeld na ontvangst van de resultaten van een hormonaal onderzoek (TSH-spiegel, vrije thyroxine).
Correctie van NLF kan op twee manieren worden uitgevoerd: de eerste is ovulatiestimulatie, de tweede is substitutietherapie met progesteronpreparaten.
De eerste behandelingsoptie is ovulatiestimulatie met clomifeencitraat. Deze behandelmethode is gebaseerd op het feit dat de meeste aandoeningen in de luteale fase zich in de folliculaire fase van de cyclus voordoen. Constant verlaagde progesteronspiegels in de tweede fase zijn een gevolg van een verstoorde folliculogenese in de eerste fase van de cyclus. Deze aandoening kan met meer succes worden gecorrigeerd door lage doses clomifeencitraat in de vroege folliculaire fase dan door progesteron voor te schrijven in de tweede fase van de cyclus.
In de eerste cyclus bedraagt de dosis clomifeencitraat 50 mg/dag, van de 5e tot en met de 9e dag van de menstruatiecyclus. De effectiviteit wordt gecontroleerd met behulp van rectale temperatuurmetingen, progesteronmetingen in de 2e fase van de cyclus of dynamische echografie. Indien er in de tweede cyclus van ovulatiestimulatie onvoldoende effect is, dient de dosis clomifeencitraat te worden verhoogd tot 100 mg/dag, van de 5e tot en met de 9e dag van de cyclus. De maximaal mogelijke dosis in de derde cyclus van ovulatiestimulatie is 150 mg/dag. Een dergelijke dosisverhoging is alleen mogelijk als het medicijn goed wordt verdragen (geen hevige pijn in de onderbuik en onderrug en geen andere tekenen van ovariële hyperstimulatie).
De tweede behandelingsoptie: substitutietherapie met progesteronpreparaten, die een volledige secretoire transformatie van het endometrium bevorderen, wat het gewenste effect geeft bij patiënten met een recidiverende miskraam met behouden ovulatie. Bovendien is de afgelopen jaren vastgesteld dat toediening van progesteronpreparaten niet alleen een hormonaal, maar ook een immunomodulerend effect heeft, door afstotingsreacties van immunocompetente cellen in het endometrium te onderdrukken. Een vergelijkbaar effect is met name beschreven voor dihydrogesteron in een dosis van 20 mg/dag. Voor substitutietherapie wordt dydrogesteron gebruikt in een dosis van 20 mg/dag oraal of gemicroniseerd progesteron vaginaal in een dosis van 200 mg/dag. De behandeling wordt uitgevoerd op de tweede dag na de ovulatie (de dag na de stijging van de rectale temperatuur) en duurt 10 dagen. Indien zwangerschap optreedt, dient de behandeling met progesteronpreparaten te worden voortgezet.
Modern onderzoek heeft de effectiviteit van humaan choriongonadotrofine bij de behandeling van herhaalde miskramen niet bevestigd.
Bij hyperandrogenisme (ovarium- of bijniergenese) bij patiënten met een recidiverende miskraam is medicamenteuze behandeling geïndiceerd vanwege het effect van androgenen op de volledigheid van de ovulatie en de toestand van het endometrium. Bij een verstoring van de biosynthese van bijnierandrogenen is hun viriliserende effect op de vrouwelijke foetus mogelijk; daarom wordt steroïdetherapie toegepast in het belang van de foetus.
Hyperandrogenisme van de eierstokken (polycysteuze eierstokken)
Anamnese, lichamelijk onderzoek en uitslagen van het speciaal onderzoek
- Voorgeschiedenis: late menarche, menstruatiecyclusstoornissen zoals oligomenorroe (meestal primair, minder vaak secundair). Zwangerschappen komen zelden voor, meestal spontaan onderbroken in het eerste trimester, met lange periodes van onvruchtbaarheid tussen de zwangerschappen.
- Onderzoek: hirsutisme, acne, striae, hoge BMI (optioneel).
- Rectale temperatuurgrafieken: anovulatoire cycli wisselen af met cycli met ovulatie en NLF.
- Hormonaal onderzoek: hoge testosteronspiegels, FSH- en LH-spiegels kunnen verhoogd zijn, LH/FSH-ratio is groter dan 3. Echografie: polycysteuze eierstokken.
Behandeling
Niet-medicamenteuze behandeling
Gewichtsverlies - dieettherapie, fysieke activiteit.
Medicamenteuze behandeling
- Orlistat in een dosering van 120 mg bij elke hoofdmaaltijd. De duur van de kuur wordt bepaald op basis van het effect en de verdraagbaarheid.
- Voorlopige testosteronverlaging met preparaten die cyproteronacetaat (2 mg) en EE (35 mcg) bevatten, gedurende 3 menstruatiecycli.
- Stopzetting van anticonceptie, hormonale ondersteuning van de tweede fase van de cyclus (gestageentherapie) - dydrogesteron in een dosering van 20 mg/dag vanaf de 16e tot en met de 25e dag van de menstruatiecyclus. Als er geen spontane ovulatie optreedt, ga dan verder met de volgende fase.
- Stimulatie van de ovulatie met clomifeencitraat in een startdosis van 50 mg/dag vanaf de 5e tot en met de 9e dag van de menstruatiecyclus met gelijktijdige behandeling met gestagenen (dydrogesteron in een dosis van 20 mg/dag vanaf de 16e tot en met de 25e dag van de cyclus) en dexamethason (0,5 mg).
- Bij afwezigheid van zwangerschap wordt de dosis clomifeencitraat verhoogd tot 100-150 mg/dag met toediening van gestagenen in de tweede fase van de cyclus en dexamethason (0,5 mg). Het is vastgesteld dat, hoewel dexamethason alleen de concentratie androgenen in de bijnieren verlaagt, ovulatie en conceptie significant vaker voorkomen bij behandeling met clomifeencitraat en dexamethason dan bij gebruik van clomifeencitraat alleen [12].
- Er worden drie cycli van ovulatiestimulatie uitgevoerd, waarna een pauze van drie menstruatiecycli met gestagene ondersteuning wordt aanbevolen en een beslissing over een chirurgische behandeling met laparoscopische toegang (wigvormige resectie van de eierstokken, laservaporisatie).
Verdere behandeling van de patiënt
Zwangerschapsbegeleiding dient tot 16 weken zwangerschap gepaard te gaan met zwangerschapsondersteuning (dydrogesteron in een dosering van 20 mg/dag of gemicroniseerd progesteron in een dosering van 200 mg/dag). Dexamethason wordt alleen voorgeschreven in het eerste trimester van de zwangerschap. Monitoring is verplicht voor tijdige diagnose van isthmisch-cervicale insufficiëntie en, indien nodig, chirurgische correctie ervan.
Bijnierhyperandrogenisme (puberaal en postpuberaal adrenogenitaal syndroom)
Adrenogenitaal syndroom (AGS) is een erfelijke ziekte die gepaard gaat met een verstoring van de hormoonproductie in de bijnierschors als gevolg van schade aan genen die verantwoordelijk zijn voor de synthese van een aantal enzymsystemen. De ziekte wordt autosomaal recessief overgeërfd door de overdracht van gemuteerde genen van beide ouders, die gezonde dragers zijn.
In 90% van de gevallen wordt het adrenogenitaal syndroom veroorzaakt door mutaties in het CYP21B-gen, waardoor de synthese van 21-hydroxylase verstoord raakt.
Anamnese, lichamelijk onderzoek en uitslagen van het speciaal onderzoek
- Voorgeschiedenis: late menarche, licht verlengde menstruatiecyclus, mogelijke oligomenorroe, spontane abortussen in het eerste trimester, mogelijke onvruchtbaarheid.
- Onderzoek: acne, hirsutisme, androïde lichaamstype (brede schouders, smal bekken), clitorishypertrofie.
- Rectale temperatuurgrafieken: anovulatoire cycli wisselen af met cycli met ovulatie en NLF.
- Hormonale test: hoge niveaus van 17-OP, DHEAS.
- Echografie: eierstokken zijn onveranderd.
Een pathognomonisch teken buiten de zwangerschap is een verhoogde concentratie van 17-OP in het bloedplasma.
Momenteel wordt een ACTH-test gebruikt om de latente, niet-klassieke vorm van adrenale hyperandrogenisme te diagnosticeren. Hiervoor wordt Synacthen gebruikt – een synthetisch polypeptide met de eigenschappen van endogeen ACTH, d.w.z. het stimuleert de eerste fasen van de synthese van steroïde hormonen uit cholesterol in de bijnieren.
Synacthen-test (een ACTH-analoog): 1 ml (0,5 mg) synacthen wordt subcutaan in de schouder geïnjecteerd. Het initiële gehalte aan 17-OP en cortisol wordt eerst bepaald in het ochtendplasmamonster van 9 uur. Negen uur na de injectie wordt een controlebloedmonster afgenomen om het gehalte aan 17-OP en cortisol te bepalen. De bepalingsindex (D) wordt vervolgens berekend met de formule:
D = 0,052 × 17-OP + 0,005 × Cortisol/17-OP - 0,018 × Cortisol/17-OP
Als de D-coëfficiënt kleiner of gelijk is aan 0,069, duidt dit op de afwezigheid van bijnierhyperandrogenisme. Is de D-coëfficiënt groter dan 0,069, dan moet worden aangenomen dat hyperandrogenisme wordt veroorzaakt door een disfunctie van de bijnieren.
Medicamenteuze behandeling
De hoeksteen van de behandeling van hyperandrogenisme als gevolg van 21-hydroxylasedeficiëntie zijn glucocorticoïden, die worden gebruikt om de overmatige androgeensecretie te onderdrukken.
Verdere behandeling van de patiënt
Vanwege het viriliserende effect van maternale androgenen op de foetus, wordt bij een vastgestelde diagnose van adrenale hyperandrogenisme een behandeling met dexamethason voorgeschreven in een startdosis van 0,25 mg vóór de zwangerschap en voortgezet in een individueel gekozen dosis (van 0,5 tot 1 mg) gedurende de zwangerschap. Bij een vrouw met een recidiverende miskraam en adrenale hyperandrogenisme is het niet wenselijk om de behandeling te staken, aangezien de frequentie van miskramen zonder behandeling 14% bedraagt en bij voortzetting - 9%.
Aangezien patiënten met het adrenogenitaal syndroom dit gen kunnen doorgeven aan de foetus, is prenatale diagnostiek noodzakelijk: bij 17-18 weken zwangerschap wordt een bloedonderzoek voorgeschreven om het 17-OP-gehalte bij de moeder te bepalen. Als de bloedspiegel van het hormoon verhoogd is, wordt de concentratie ervan in het vruchtwater bepaald. Als de hoeveelheid 17-OP in het vruchtwater verhoogd is, wordt de diagnose adrenogenitaal syndroom bij de foetus gesteld. Helaas is het onmogelijk om de ernst van het adrenogenitaal syndroom (milde of ernstige zoutverliezende vorm) te bepalen aan de hand van de 17-OP-waarde in het vruchtwater. De vraag of de zwangerschap in deze situatie in stand moet worden gehouden, wordt door de ouders beslist.
Als de vader van het kind drager is van het gen voor adrenogenitaal syndroom en er gevallen zijn van kinderen met dit syndroom in de familie, dan krijgt de patiënt, zelfs zonder adrenale hyperandrogenisme, dexamethason in het belang van de foetus (om virilisatie van de vrouwelijke foetus te voorkomen) in een dosis van 20 mcg/kg lichaamsgewicht, maximaal 1,5 mg/dag, verdeeld over 2-3 doses na de maaltijd. Na 17-18 weken, na vaststelling van het geslacht van de foetus en de expressie van het gen voor adrenogenitaal syndroom (op basis van de resultaten van de vruchtwaterpunctie), wordt de behandeling voortgezet tot het einde van de zwangerschap als de foetus een meisje met adrenogenitaal syndroom is. Als de foetus een jongen of een meisje is dat geen drager is van het gen voor adrenogenitaal syndroom, kan de behandeling met dexamethason worden stopgezet.
Als een vrouw met een recidiverende miskraam lijdt aan bijnierhyperandrogenisme, wordt dexamethasonbehandeling gedurende de gehele zwangerschap voortgezet en pas na de bevalling stopgezet. Op de derde dag na de bevalling wordt de dosis dexamethason geleidelijk verlaagd (met 0,125 mg om de drie dagen) tot volledige stopzetting in de postpartumperiode.
Hyperandrogenisme van gemengde genese (ovarium- en bijnierschorssyndroom)
Anamnese, lichamelijk onderzoek en uitslagen van het speciaal onderzoek
- Voorgeschiedenis: late menarche, menstruatiecyclusstoornissen zoals oligomenorroe (meestal primair, minder vaak secundair), amenorroe, mogelijk letsel, hersenschudding. Zwangerschappen komen zelden voor, meestal spontaan onderbroken in het eerste trimester, lange periodes van onvruchtbaarheid tussen de zwangerschappen.
- Lichamelijk onderzoek: hirsutisme, acne, striae, acanthosis nigricans, hoge BMI, hypertensie.
- Rectale temperatuurgrafieken: anovulatoire cycli wisselen af met cycli met ovulatie en NLF.
- Hormonaal onderzoek: hoge testosteronspiegels, verhoogde FSH- en LH-spiegels, LH/FSH-ratio groter dan 3, hoge DHEAS- en 17-OP-spiegels, hyperprolactinemie kan aanwezig zijn.
- Echografie: polycysteuze eierstokken.
- Elektro-encefalografie: veranderingen in de bio-elektrische activiteit van de hersenen.
- Hyperinsulinemie, stoornis van de lipidenstofwisseling (hoog cholesterol, lagedichtheidslipoproteïnen en zeer lagedichtheidslipoproteïnen), verminderde glucosetolerantie of verhoogde bloedglucosewaarden.
Behandeling
Niet-medicamenteuze behandeling
Gewichtsverlies (caloriearm dieet, lichaamsbeweging).
Medicamenteuze behandeling
Eerste fase: bij insulineresistentie wordt aanbevolen om metformine voor te schrijven in een dagelijkse dosis van 1000-1500 mg om de insulinegevoeligheid te verhogen.
Tweede fase - bij ernstige menstruatiecyclusstoornissen en hoge testosteronspiegels wordt aangeraden om gedurende 3 maanden geneesmiddelen met een anti-androgene werking voor te schrijven die cyproteronacetaat (2 mg) en ethinylestradiol (35 mcg) bevatten.
De derde fase bestaat uit het stimuleren van de ovulatie, gevolgd door ondersteuning van de zwangerschapsstimulatie (het schema is hierboven beschreven) en het innemen van dexamethason in een dagelijkse dosis van 0,25–0,5 mg.
Bij hyperprolactinemie en hypothyreoïdie dient een passende medicatiecorrectie te worden uitgevoerd tijdens de ovulatiestimulatiecycli. Indien zwangerschap optreedt, dient de behandeling met bromocriptine te worden gestaakt en dient de behandeling met levothyroxine te worden voortgezet.
Indien de ovulatiestimulatie niet effectief is, dient te worden besloten of er directe ovulatie-inductoren moeten worden voorgeschreven, of dat chirurgische behandeling van polycysteuze eierstokken of in-vitrofertilisatie wenselijk is.
Verdere behandeling van de patiënt
Bij patiënten met het metaboolsyndroom wordt de zwangerschap vaak gecompliceerd door arteriële hypertensie, nefropathie en hypercoagulatie. In dit verband is het noodzakelijk om vanaf de vroege zwangerschap de bloeddruk te controleren, hemostasiogrammen te maken en de ontstane aandoeningen (indien nodig) te corrigeren met antihypertensiva, bloedplaatjesaggregatieremmers en anticoagulantia. Gestagene geneesmiddelen worden voorgeschreven tot 16 weken zwangerschap: didrogesteron in een dosis van 20 mg/dag of gemicroniseerd progesteron in een dosis van 200 mg/dag, verdeeld over 2 doses.
Alle vrouwen met hyperandrogenisme vormen een risicogroep voor het ontwikkelen van isthmisch-cervicale insufficiëntie. Vanaf de 16e week van de zwangerschap dient de conditie van de cervix te worden gecontroleerd, indien nodig kan chirurgische correctie van isthmisch-cervicale insufficiëntie worden overwogen.
Immunologische oorzaken van een gewoonte-miskraam
Het is momenteel bekend dat ongeveer 80% van alle voorheen onverklaarde gevallen van herhaalde miskramen (na uitsluiting van genetische, anatomische en hormonale oorzaken) verband houdt met immuunstoornissen. Er wordt onderscheid gemaakt tussen auto-immuunziekten en allo-immuunziekten, die leiden tot een habituele miskraam.
Bij auto-immuunprocessen worden de eigen weefsels van het immuunsysteem het doelwit van agressie, d.w.z. de immuunreactie is gericht tegen de eigen antigenen. In deze situatie lijdt de foetus secundair onder de schade aan de weefsels van de moeder.
Bij alloimmuunziekten is de immuunreactie van een vrouw gericht tegen embryonale/foetale antigenen die ze van de vader heeft gekregen en die mogelijk vreemd zijn voor het lichaam van de moeder.
Auto-immuunziekten die het vaakst voorkomen bij patiënten met een habituele miskraam, zijn onder meer de aanwezigheid van antifosfolipide-, antithyroid- en antinucleaire auto-antilichamen in het serum. Zo is vastgesteld dat 31% van de vrouwen met een habituele miskraam buiten de zwangerschap auto-antilichamen tegen thyreoglobuline en schildklierperoxidase (schildkliermicrosomale [schildklierperoxidase]-auto-antilichamen) heeft; in deze gevallen loopt het risico op een spontane miskraam in het eerste trimester van de zwangerschap op tot 20%. Bij een habituele miskraam wijst de aanwezigheid van antinucleaire en antithyroid-antilichamen op de noodzaak van verder onderzoek om het auto-immuunproces te identificeren en de diagnose te bevestigen.
Het antifosfolipidensyndroom (APS) is een algemeen erkende auto-immuunziekte die leidt tot de dood van embryo's/foetussen.
Allo-immuunziekten
Momenteel omvatten allo-immuunprocessen die leiden tot afstoting van de foetus de aanwezigheid van een verhoogd (meer dan 3) aantal gemeenschappelijke antigenen van het majeure histocompatibiliteitscomplexsysteem bij echtgenoten (vaak waargenomen bij consanguine huwelijken); lage niveaus van blokkerende factoren in het serum van de moeder; verhoogde niveaus van natural killer-cellen (NK-cellen CD56, CD16) in het endometrium en het perifere bloed van de moeder, zowel buiten als tijdens de zwangerschap; hoge concentratieniveaus van een aantal cytokinen in het endometrium en het bloedserum, met name γ-interferon, tumornecrosefactor a, interleukinen-1 en 2.
Momenteel wordt onderzoek gedaan naar allo-immuunfactoren die leiden tot vroegtijdige zwangerschapsafbrekingen en naar manieren om deze aandoeningen te corrigeren. Er is geen consensus over de behandelmethoden. Volgens sommige onderzoekers heeft actieve immunisatie met donorlymfocyten geen significant effect, terwijl andere auteurs een significant positief effect beschrijven bij dergelijke immunisatie en behandeling met immunoglobulinen.
Progesteron is momenteel een van de immunomodulerende middelen tijdens de vroege zwangerschap. Studies hebben met name de rol van dydrogesteron in een dagelijkse dosis van 20 mg aangetoond bij vrouwen met een herhaalde miskraam in het eerste trimester van de zwangerschap met een verhoogd aantal CD56-cellen in het endometrium.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Genetisch bepaalde trombofilieën
De volgende vormen van genetisch bepaalde trombofilie worden beschouwd als trombofiele aandoeningen tijdens de zwangerschap die leiden tot een miskraam.
- Antitrombine III-deficiëntie.
- Factor V-mutatie (Leiden-mutatie).
- Proteïne C-tekort.
- Proteïne S-tekort.
- Protrombine-genmutatie G20210A.
- Hyperhomocysteïnemie.
Onderzoek om zeldzame oorzaken van trombofilie te identificeren is noodzakelijk in gevallen waarin er sprake is van:
- familiegeschiedenis - trombo-embolie vóór de leeftijd van 40 jaar bij familieleden;
- betrouwbare episodes van veneuze en/of arteriële trombose vóór de leeftijd van 40 jaar;
- terugkerende trombose bij de patiënt en zijn directe familieleden;
- trombo-embolische complicaties tijdens de zwangerschap en na de bevalling bij gebruik van hormonale anticonceptie;
- herhaalde miskramen, doodgeboortes, intra-uteriene groeivertraging, placenta-abruptie;
- vroegtijdige preeclampsie, HELLP-syndroom.
Infectieuze oorzaken van een gewoonte-miskraam
De rol van de infectieuze factor als oorzaak van een habituele miskraam wordt momenteel breed bediscussieerd. Het is bekend dat een primaire infectie in de vroege stadia van de zwangerschap schade aan het embryo kan veroorzaken die onverenigbaar is met het leven, wat leidt tot sporadische spontane miskramen. De kans op reactivatie van de infectie met als gevolg herhaalde miskramen is echter verwaarloosbaar. Bovendien zijn er momenteel geen micro-organismen gevonden die een habituele miskraam veroorzaken. Studies van de afgelopen jaren hebben aangetoond dat de meeste vrouwen met een habituele miskraam en chronische endometritis een prevalentie hebben van 2-3 of meer soorten obligaat anaërobe micro-organismen en virussen in het endometrium.
Volgens VM Sidelnikova et al. werd bij vrouwen met een habituele miskraam de diagnose chronische endometritis buiten de zwangerschap in 73,1% van de gevallen histologisch bevestigd en in 86,7% werd persistentie van opportunistische micro-organismen in het endometrium waargenomen, wat zeker de oorzaak kan zijn van de activering van immunopathologische processen. Gemengde persistente virale infecties (herpes simplex-virus, Coxsackie A, Coxsackie B, enterovirussen 68-71, cytomegalovirus) worden significant vaker aangetroffen bij patiënten met een habituele miskraam dan bij vrouwen met een normale obstetrische voorgeschiedenis. K. Kohut et al. (1997) toonden aan dat het percentage ontstekingsveranderingen in het endometrium en deciduale weefsel bij patiënten met een primaire recidief miskraam significant hoger is dan bij vrouwen na een miskraam met een voorgeschiedenis van ten minste één voldragen bevalling.
Bacteriële en virale kolonisatie van het endometrium is meestal het gevolg van het onvermogen van het immuunsysteem en de niet-specifieke beschermende krachten van het lichaam (het complementsysteem, fagocytose) om de infectieuze agens volledig te elimineren. Tegelijkertijd wordt de verspreiding ervan beperkt door de activering van T-lymfocyten (T-helpers, natural killers) en macrofagen. In alle bovengenoemde gevallen treedt persistentie van micro-organismen op, gekenmerkt door de aantrekkingskracht van mononucleaire fagocyten, natural killers en T-helpers, die verschillende cytokinen synthetiseren, naar de plaats van chronische ontsteking. Blijkbaar verhindert een dergelijke toestand van het endometrium de vorming van lokale immunosuppressie in de pre-implantatieperiode, die noodzakelijk is om een beschermende barrière te vormen en afstoting van een half-vreemde foetus te voorkomen.
In dit verband moet vóór de zwangerschap bij vrouwen met een habituele miskraam de diagnose chronische endometritis worden gesteld. Om deze diagnose vast te stellen of uit te sluiten, wordt op de 7e-8e dag van de menstruatiecyclus een endometriumbiopsie uitgevoerd, met histologisch onderzoek, PCR en bacteriologisch onderzoek van het materiaal uit de baarmoederholte. Om de diagnose te bevestigen, wordt chronische endometritis behandeld volgens de normen voor de behandeling van ontstekingsziekten van de bekkenorganen.

