Medisch expert van het artikel
Nieuwe publicaties
Eierstok
Laatst beoordeeld: 04.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
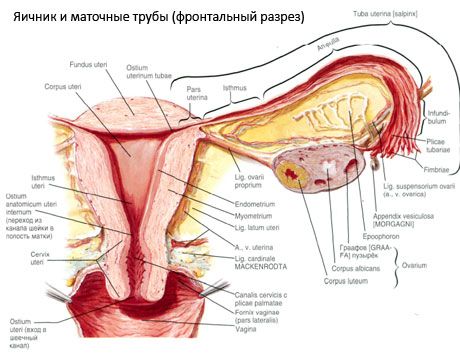
De eierstok (ovarium; Grieks oophoron) is een gepaard orgaan, een vrouwelijke voortplantingsklier, gelegen in de bekkenholte achter het brede ligament van de baarmoeder. In de eierstokken ontwikkelen en rijpen vrouwelijke voortplantingscellen (eicellen) en worden vrouwelijke geslachtshormonen gevormd die in het bloed en de lymfe terechtkomen. De eierstok is ovaal van vorm, enigszins afgeplat in de anteroposterieure richting. De kleur van de eierstok is rozeachtig. Op het oppervlak van de eierstok van een vrouw die bevallen is, zijn inkepingen en littekens zichtbaar - sporen van de ovulatie en de transformatie van de corpora lutea. De eierstok weegt 5-8 g. De afmetingen van de eierstok zijn: lengte 2,5-5,5 cm, breedte 1,5-3,0 cm, dikte - tot 2 cm. De eierstok heeft twee vrije vlakken: het mediale vlak (facies medialis), dat naar de bekkenholte is gericht en gedeeltelijk bedekt is door de eileider, en het laterale vlak (facies lateralis), dat grenst aan de zijwand van het bekken en een licht uitgesleten holte vormt - de fossa ovaria. Deze fossa bevindt zich in de hoek tussen de externe iliacale vaten, die aan de bovenkant bedekt zijn met peritoneum, en de uterinae en obturatore a. onderaan. Achter de eierstok loopt de ureter van de corresponderende zijde retroperitoneaal van boven naar beneden.
De oppervlakken van de eierstok gaan over in een convexe vrije (achterste) rand (margo liber), aan de voorkant in de mesenteriale rand (margo mesovaricus), die door middel van een korte plooi van het peritoneum (mesenterium van de eierstok) vastzit aan het achterste blaadje van het ligamentum uteri (baarmoederband). Aan deze voorste rand van het orgaan bevindt zich een gegroefde verdieping - het hilum van de eierstok (hilum ovarii), waardoor de slagader en zenuwen de eierstok binnenkomen en de aderen en lymfevaten eruit komen. De eierstok heeft ook twee uiteinden: het afgeronde bovenste buisvormige uiteinde (extremitas tubaria), dat naar de eileider is gericht, en het onderste uteriene uiteinde (extremitas utenna), dat met de baarmoeder is verbonden door het ligamentum ovarium (lig. ovarii proprium). Dit ligament, in de vorm van een ronde streng van ongeveer 6 mm dik, loopt van het uteriene uiteinde van de eierstok naar de laterale hoek van de baarmoeder, gelegen tussen de twee bladen van het brede ligament van de baarmoeder. Het ligamenteuze apparaat van de eierstok omvat ook het ligament suspensorium ovarii van de eierstok, een plooi van het peritoneum die loopt van de wand van het kleine bekken naar de eierstok en die de ovariumvaten en bundels vezelachtige vezels binnenin bevat. De eierstok wordt gefixeerd door een kort mesenterium (mesovarium), een duplicatie van het peritoneum dat loopt van het achterste blaadje van het brede ligament van de baarmoeder naar de mesenteriale rand van de eierstok. De eierstokken zelf zijn niet bedekt met het peritoneum. De grootste ovariumrand van de eileider is bevestigd aan het buisvormige uiteinde van de eierstok. De topografie van de eierstokken hangt af van de positie van de baarmoeder en de grootte ervan (tijdens de zwangerschap). De eierstokken zijn zeer mobiele organen in de kleine bekkenholte.
Vaten en zenuwen van de eierstok
De bloedtoevoer naar de eierstokken wordt verzorgd door aa. en vv. ovaricae en uterinae. Beide ovariumarteriën (aa. ovaricae dextra en sinistra) ontspringen aan de voorzijde van de aorta, net onder de nierarteriën; de rechter ontspringt meestal aan de aorta en de linker aan de nierarterie. Beide ovariumarteriën, die naar beneden en lateraal langs de voorzijde van de psoas major lopen, kruisen de ureter aan de voorzijde (waarvan zij aftakkingen hebben), de vaten van de iliaca externa, de grenslijn en komen de bekkenholte binnen, waar zij zich in het ophangingsligament van de eierstok bevinden. Mediaal volgend, passeert de ovariumarterie tussen de bladen van het brede ligament van de baarmoeder onder de eileider door, waar zij aftakkingen heeft, en vervolgens in het mesenterium van de eierstok terechtkomt; zij komt de hilus van de eierstok binnen.
De takken van de arteria ovaria anastomoseren wijd met de takken van de arteria uterina. De veneuze uitstroom vanuit de eierstokken vindt voornamelijk plaats in de veneuze plexus ovaria, gelegen ter hoogte van de hilus van de eierstokken. Van hieruit stroomt het bloed in twee richtingen: door de vena uterina en de vena ovaria. De rechter vena ovaria heeft kleppen en mondt uit in de vena cava inferior. De linker vena ovaria mondt uit in de linker vena renalis, hoewel deze geen kleppen heeft.
Lymfedrainage vanuit de eierstokken vindt plaats via de lymfevaten, met name overvloedig in het gebied van de orgaanpoort, waar de subovariële lymfeplexus zich bevindt. Vervolgens wordt de lymfe via de lymfevaten in de eierstokken afgevoerd naar de para-aortale lymfeklieren.
Innervatie van de eierstokken
Sympathisch - verzorgd door postganglionaire vezels van de plexus coeliacus (zonnevlecht), de plexus mesenterialis superior en de hypogastrische plexus; parasympathisch - verzorgd door de viscero-sacraalzenuwen.
Structuur van de eierstok
Het oppervlak van de eierstok is bedekt met een enkellaags kiemepitheel. Daaronder ligt een dichte eiwitmantel van bindweefsel (tunica albuginea). Het bindweefsel van de eierstok vormt het stroma (stroma ovarii), rijk aan elastische vezels. De substantie van de eierstok, het parenchym, is verdeeld in een buiten- en een binnenlaag. De binnenste laag, gelegen in het midden van de eierstok, dichter bij de ingang, wordt de medulla (medulla ovarii) genoemd. In deze laag, bestaande uit los bindweefsel, bevinden zich talrijke bloed- en lymfevaten en zenuwen. De buitenste laag van de eierstok - de cortex (cortex ovarii) - is dichter. Het bevat veel bindweefsel, waarin zich de rijpende primaire follikels van de eierstokken (folliculi ovarici primarii), secundaire (vesiculaire) follikels (folliculi ovarici secundarii, s.vesiculosi) bevinden, evenals volwassen follikels, Graafse follikels (folliculi ovarici maturis), evenals gele en atretische lichamen.
Elke follikel bevat een vrouwelijke eicel, oftewel oöcyt (ovocytus). De eicel heeft een diameter tot 150 µm, is rond en bevat een celkern, een grote hoeveelheid cytoplasma, dat naast celorganellen ook eiwit-lipide insluitsels (dooier) en glycogeen bevat, noodzakelijk voor de voeding van de eicel. De eicel verbruikt zijn voorraad voedingsstoffen gewoonlijk binnen 12-24 uur na de eisprong. Als er geen bevruchting plaatsvindt, sterft de eicel.
De menselijke eicel is bedekt met twee membranen. Binnenin bevindt zich het cytolemma, het cytoplasmatisch membraan van de eicel. Buiten het cytolemma bevindt zich een laag zogenaamde folliculaire cellen, die de eicel beschermen en een hormoonvormende functie hebben: ze scheiden oestrogenen af.
De fysiologische positie van de baarmoeder, eileiders en eierstokken wordt bepaald door de ophang-, fixatie- en ondersteuningsorganen die het peritoneum, de ligamenten en het bekkenweefsel met elkaar verbinden. Het ophangorgaan wordt gevormd door paren, waaronder de ronde en brede ligamenten van de baarmoeder, de eigenlijke ligamenten en de ophangligamenten van de eierstokken. De brede ligamenten van de baarmoeder, de eigenlijke ligamenten en de ophangligamenten van de eierstokken houden de baarmoeder in de middelste positie. De ronde ligamenten trekken de fundus van de baarmoeder naar voren en zorgen voor de fysiologische kanteling.
Het fixatieapparaat (verankering) zorgt voor de positie van de baarmoeder in het midden van het kleine bekken en maakt het praktisch onmogelijk dat deze naar de zijkanten, heen en weer beweegt. Omdat het ligamentaire apparaat zich echter in het onderste deel van de baarmoeder bevindt, zijn kantelingen van de baarmoeder in verschillende richtingen mogelijk. Het fixatieapparaat omvat ligamenten die zich in het losse weefsel van het bekken bevinden en zich uitstrekken van het onderste deel van de baarmoeder naar de laterale, voorste en achterste bekkenwanden: sacromagische, kardinale, uterovesicale en vesicopubische ligamenten.
Naast het mesovarium worden de volgende ovariumligamenten onderscheiden:
- Het ophangligament van de eierstok, voorheen aangeduid als het infundibulopelvicum. Het is een plooi van het peritoneum met bloedvaten (a. et v. ovarica), lymfevaten en zenuwen van de eierstok die erdoorheen lopen, gespannen tussen de laterale wand van het bekken, de lumbale fascia (in het gebied waar de a. iliaca communis zich splitst in externa en interna) en het bovenste (tubaire) uiteinde van de eierstok;
- Het eigen ligament van de eierstok loopt tussen de bladen van het brede ligament van de baarmoeder, dichter bij het achterste blad, en verbindt het onderste uiteinde van de eierstok met de laterale rand van de baarmoeder. Het eigen ligament van de eierstok is aan de baarmoeder bevestigd tussen het begin van de eileider en het ronde ligament, achter en boven dit laatste. In de dikte van het ligament lopen rr. ovarii, de eindtakken van de arteria uterina;
- Het ligament loopt van het mesenterium van de appendix naar de rechter eierstok of het brede ligament van de baarmoeder in de vorm van een plooi van het peritoneum. Het ligament is inconstant en wordt waargenomen bij 1/2 tot 1/3 van de vrouwen.
Het ondersteunende apparaat wordt gevormd door de spieren en het bindweefsel van de bekkenbodem, verdeeld in de onderste, middelste en bovenste (binnenste) lagen.
De krachtigste spierlaag is de bovenste (binnenste) spierlaag, vertegenwoordigd door de spier die de anus optilt. Deze bestaat uit spierbundels die zich in drie richtingen (pubococcygeus, iliococcygeus en ischiococcygeus) uitstrekken van het stuitbeen tot aan de bekkenbeenderen. Deze spierlaag wordt ook wel het bekkendiafragma genoemd.
De middelste spierlaag bevindt zich tussen de symfyse, het schaambeen en het zitbeen. De middelste spierlaag – het urogenitale diafragma – beslaat de voorste helft van de bekkenuitgang, waardoor de urethra en de vagina lopen. In het voorste deel, tussen de bladen ervan, bevinden zich spierbundels die de externe sluitspier van de urethra vormen, in het achterste deel bevinden zich spierbundels die in dwarsrichting lopen – de diepe dwarsspier van het perineum.
De onderste (buitenste) laag van de bekkenbodemspieren bestaat uit oppervlakkige spieren, waarvan de vorm lijkt op het getal 8. Hiertoe behoren de bulbocaverneuze, ischiocaverneuze, externe anale sluitspier en oppervlakkige transversale perineale spier.
Ontogenese van de eierstokken
Het proces van follikelgroei en -atresie begint rond de 20e week van de zwangerschap en tegen de tijd van de bevalling bevinden zich nog steeds tot 2 miljoen eicellen in de eierstokken van het meisje. Tegen de tijd van de menarche neemt hun aantal af tot 300.000. Gedurende de gehele vruchtbare periode bereiken maximaal 500 follikels de volwassenheid en ovuleren ze. De initiële groei van follikels is niet afhankelijk van FSH-stimulatie, is beperkt en atresie treedt snel op. Men neemt aan dat in plaats van steroïde hormonen, lokale autocriene/paracriene peptiden de belangrijkste regulator zijn van de groei en atresie van primaire follikels. Men neemt aan dat het proces van follikelgroei en -atresie niet wordt onderbroken door fysiologische processen. Dit proces gaat door op alle leeftijden, inclusief de intra-uteriene periode en de menopauze, en wordt onderbroken door zwangerschap, ovulatie en anovulatie. Het mechanisme dat de follikelgroei en hun aantal in elke specifieke cyclus in gang zet, is nog onduidelijk.
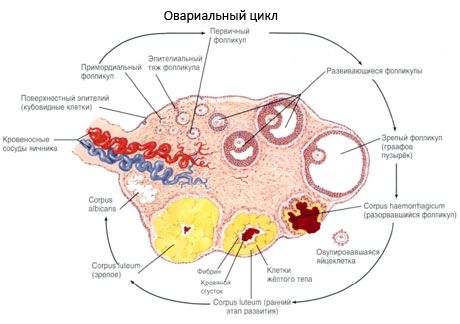
Tijdens de ontwikkeling doorloopt de follikel verschillende ontwikkelingsstadia. Primordiale kiemcellen ontstaan in het endoderm van de dooierzak, de allantois, en migreren naar de genitale zone van het embryo in de vijfde tot zesde week van de zwangerschap. Door de snelle mitotische deling, die doorloopt van zesde tot achtste week tot zestien tot twintig weken van de zwangerschap, worden er tot wel zes tot zeven miljoen eicellen gevormd in de eierstokken van het embryo, omgeven door een dunne laag granulosacellen.
Preantrale follikel - de eicel is omgeven door een membraan (Zona pellucida). Granulosacellen rondom de eicel beginnen te prolifereren; hun groei is afhankelijk van gonadotropinen en correleert met de oestrogeenspiegel. Granulosacellen zijn het doelwit van FSH. In het preantrale follikelstadium zijn granulosacellen in staat drie klassen steroïden te synthetiseren: induceert voornamelijk de activiteit van aromatase, het belangrijkste enzym dat androgenen omzet in oestradiol. Men gelooft dat oestradiol in staat is het aantal eigen receptoren te verhogen en zo een direct mitogeen effect op granulosacellen uit te oefenen, onafhankelijk van FSH. Het wordt beschouwd als een paracriene factor die de effecten van FSH versterkt, waaronder de activering van aromatiseringsprocessen.
FSH-receptoren verschijnen op de membranen van granulosacellen zodra de follikelgroei begint. Een afname of toename van FSH leidt tot een verandering in het aantal receptoren. Deze werking van FSH wordt gemoduleerd door groeifactoren. FSH werkt via het G-proteïne, het adenylaatcyclasesysteem. Hoewel de steroïdogenese in de follikel voornamelijk door FSH wordt gereguleerd, zijn er veel factoren betrokken bij dit proces: ionkanalen, tyrosinekinasereceptoren en het fosfolipasesysteem van tweede boodschappers.
De rol van androgenen in de vroege follikelontwikkeling is complex. Granulosacellen hebben androgeenreceptoren. Deze vormen niet alleen een substraat voor FSH-geïnduceerde aromatisering tot oestrogenen, maar kunnen de aromatisering ook bij lage concentraties versterken. Wanneer de androgeenspiegels stijgen, kiezen preantrale granulosacellen bij voorkeur niet voor de aromatiseringsroute naar oestrogenen, maar voor de eenvoudigere androgeenroute via 5α-reductase om om te zetten in een androgeen dat niet in oestrogeen kan worden omgezet, waardoor de aromataseactiviteit wordt geremd. Dit proces remt ook de vorming van FSH- en LH-receptoren, waardoor de follikelontwikkeling stopt.
Tijdens het aromatiseringsproces ondergaat de follikel met hoge androgeenspiegels atresie. De groei en ontwikkeling van de follikel is afhankelijk van het vermogen om androgenen om te zetten in oestrogenen.
In aanwezigheid van FSH zijn oestrogenen de dominante stof in de folliculaire vloeistof. Bij afwezigheid van FSH zijn het androgenen. LH is normaal gesproken afwezig in de folliculaire vloeistof tot halverwege de cyclus. Zodra de LH-spiegel stijgt, neemt de mitotische activiteit van granulosacellen af, treden degeneratieve veranderingen op en stijgt de androgeenspiegel in de follikel. De steroïdenspiegel in de folliculaire vloeistof is hoger dan in plasma en weerspiegelt de functionele activiteit van ovariumcellen: granulosacellen en thecacellen. Als granulosacellen het enige doelwit voor FSH zijn, dan heeft LH meerdere doelwitten: thecacellen, stroma- en luteïnecellen en granulosacellen. Zowel granulosacellen als thecacellen hebben het vermogen tot steroïdogenese, maar aromataseactiviteit overheerst in granulosacellen.
Als reactie op LH produceren thecacellen androgenen, die vervolgens door granulosacellen worden omgezet in oestrogenen via FSH-geïnduceerde aromatisering.
Naarmate de follikel groeit, beginnen thecacellen genen voor LH-receptoren, P450 sec en 3beta-hydroxysteroid dehydrogenase, insuline-achtige groeifactor (IGF-1) tot expressie te brengen. Insuline-achtige groeifactor (IGF-1) verhoogt synergetisch met LH de genexpressie, maar stimuleert de steroïdogenese niet.
De ovariële steroïdogenese is altijd LH-afhankelijk. Naarmate de follikel groeit, produceren thecacellen het enzym P450c17, dat androgenen uit cholesterol vormt. Granulosacellen beschikken niet over dit enzym en zijn afhankelijk van thecacellen om oestrogenen uit androgenen te produceren. In tegenstelling tot steroïdogenese is folliculogenese FSH-afhankelijk. Naarmate de follikel groeit en de oestrogeenspiegels stijgen, wordt een feedbackmechanisme geactiveerd: de FSH-productie wordt geremd, wat op zijn beurt leidt tot een afname van de aromataseactiviteit van de follikel en uiteindelijk tot folliculaire atresie door apoptose (geprogrammeerde celdood).
Het feedbackmechanisme van oestrogenen en FSH remt de ontwikkeling van follikels die al zijn begonnen te groeien, maar niet de dominante follikel. De dominante follikel bevat meer FSH-receptoren, die de proliferatie van granulosacellen en de aromatisering van androgenen tot oestrogenen ondersteunen. Daarnaast fungeren de paracriene en autocriene routes als een belangrijke coördinator van de ontwikkeling van antrale follikels.
De autocriene/paracriene regulator bestaat uit peptiden (inhibine, activine, follistatine), die door granulosacellen worden aangemaakt als reactie op FSH en in de folliculaire vloeistof terechtkomen. Inhibine vermindert de FSH-secretie; activine stimuleert de afgifte van FSH uit de hypofyse en versterkt de werking van FSH in de eierstokken; follistatine onderdrukt de FSH-activiteit, mogelijk door binding aan activine. Na de ovulatie en de ontwikkeling van het corpus luteum staat inhibine onder controle van LH.
De groei en differentiatie van ovariumcellen wordt beïnvloed door insulineachtige groeifactoren (IGE). IGF-1 werkt in op granulosacellen en veroorzaakt een toename van cyclisch adenosinemonofosfaat (cAMP), progesteron, oxytocine, proteoglycaan en inhibine.
IGF-1 werkt in op thecacellen en veroorzaakt een verhoogde androgeenproductie. Thecacellen produceren op hun beurt tumornecrosefactor (TNF) en epidermale groeifactor (EGF), die ook door FSH worden gereguleerd.
EGF stimuleert de proliferatie van granulosacellen. IGF-2 is de belangrijkste groeifactor in folliculaire vloeistof, en IGF-1, TNF-a, TNF-3 en EGF worden er ook in aangetroffen.
Verstoring van de paracriene en/of autocriene regulatie van de ovariële functie lijkt een rol te spelen bij ovulatiestoornissen en bij de ontwikkeling van polycysteuze ovaria.
Naarmate de antrale follikel groeit, neemt het oestrogeengehalte in de folliculaire vloeistof toe. Op het hoogtepunt van deze toename verschijnen LH-receptoren op de granulosacellen, vindt luteïnisatie van de granulosacellen plaats en neemt de progesteronproductie toe. In de pre-ovulatoire periode veroorzaakt een toename van de oestrogeenproductie dus het ontstaan van LH-receptoren, die op hun beurt luteïnisatie van de granulosacellen en progesteronproductie veroorzaken. Een toename van progesteron verlaagt de oestrogeenspiegel, wat blijkbaar een tweede FSH-piek in het midden van de cyclus veroorzaakt.
Men denkt dat de ovulatie 10-12 uur na de LH-piek en 24-36 uur na de oestradiolpiek plaatsvindt. Men denkt dat LH de reductiedeling van de eicel, de luteïnisatie van granulosacellen en de synthese van progesteron en prostaglandine in de follikel stimuleert.
Progesteron versterkt de activiteit van proteolytische enzymen, die samen met prostaglandine bijdragen aan het breken van de follikelwand. De progesteron-geïnduceerde piek van FSH zorgt ervoor dat de eicel de follikel kan verlaten door plasminogeen om te zetten in het proteolytische enzym plasmine, en zorgt voor een voldoende aantal LH-receptoren voor de normale ontwikkeling van de luteale fase.
Binnen 3 dagen na de ovulatie nemen de granulosacellen in omvang toe en verschijnen er karakteristieke vacuolen gevuld met pigment, luteïne. Theca-luteale cellen differentiëren van theca en stroma en worden onderdeel van het corpus luteum. Haarvaten die het corpus luteum binnendringen, ontwikkelen zich zeer snel onder invloed van angiogenetische factoren, en met verbeterde vascularisatie neemt de productie van progesteron en oestrogenen toe. De activiteit van de steroïdogenese en de levensduur van het corpus luteum worden bepaald door de LH-spiegel. Het corpus luteum is geen homogene cellulaire formatie. Naast 2 soorten luteale cellen bevat het endotheelcellen, macrofagen, fibroblasten, enz. Grote luteale cellen produceren peptiden (relaxine, oxytocine) en zijn actiever in de steroïdogenese met een hogere aromataseactiviteit en een hogere progesteronsynthese dan kleine cellen.
De progesteronpiek vindt plaats op de 8e dag na de LH-piek. Progesteron en oestradiol worden episodisch uitgescheiden in de luteale fase, in correlatie met de pulserende LH-afgifte. Met de vorming van het corpus luteum gaat de controle over de inhibineproductie over van FSH naar LH. Inhibine neemt toe met de toename van oestradiol vóór de LH-piek en blijft toenemen na de LH-piek, hoewel de oestrogeenspiegels dalen. Hoewel inhibine en oestradiol door granulosacellen worden uitgescheiden, worden ze via verschillende routes gereguleerd. De afname van inhibine aan het einde van de luteale fase draagt bij aan de toename van FSH voor de volgende cyclus.
Het corpus luteum neemt heel snel af, namelijk op de 9e tot 11e dag na de ovulatie.
Het mechanisme van degeneratie is onduidelijk en houdt geen verband met de luteolytische rol van oestrogenen of met een receptor-gerelateerd mechanisme, zoals waargenomen in het endometrium. Er is een andere verklaring voor de rol van oestrogenen, geproduceerd door het corpus luteum. Het is bekend dat oestrogenen nodig zijn voor de synthese van progesteronreceptoren in het endometrium. Oestrogenen in de luteale fase zijn waarschijnlijk noodzakelijk voor progesteron-gerelateerde veranderingen in het endometrium na de ovulatie. Onvoldoende ontwikkeling van progesteronreceptoren, als gevolg van onvoldoende oestrogeenspiegels, is mogelijk een bijkomend mechanisme voor onvruchtbaarheid en vroege zwangerschapsverliezen, een andere vorm van luteale fase-deficiëntie. Men neemt aan dat de levensduur van het corpus luteum wordt bepaald ten tijde van de ovulatie. En deze zal zeker teruglopen als deze niet wordt ondersteund door humaan choriongonadotrofine vanwege de zwangerschap. Regressie van het corpus luteum leidt dus tot een daling van de oestradiol-, progesteron- en inhibinespiegels. Een daling van inhibine heft het onderdrukkende effect op FSH op; een daling van oestradiol en progesteron zorgt voor een zeer snel herstel van de GnRH-secretie en de verwijdering van het feedbackmechanisme van de hypofyse. Een daling van inhibine en oestradiol, samen met een stijging van GnRH, leidt tot de vorming van FSH ten opzichte van LH. Een stijging van FSH leidt tot follikelgroei met daaropvolgende selectie van een dominante follikel, en een nieuwe cyclus begint als er geen zwangerschap optreedt. Steroïde hormonen spelen een hoofdrol in de reproductiebiologie en algemene fysiologie. Ze bepalen het menselijke fenotype, beïnvloeden het cardiovasculaire systeem, het botmetabolisme, de huid, het algemeen welzijn en spelen een sleutelrol tijdens de zwangerschap. De werking van steroïdhormonen weerspiegelt de intracellulaire en genetische mechanismen die nodig zijn om een extracellulair signaal naar de celkern over te brengen om een fysiologische respons te veroorzaken.
Oestrogenen dringen diffuus door het celmembraan en binden zich aan receptoren in de celkern. Het receptor-steroïdecomplex bindt zich vervolgens aan DNA. In doelcellen leiden deze interacties tot genexpressie, eiwitsynthese en specifieke cel- en weefselfuncties.


 [
[