Medisch expert van het artikel
Nieuwe publicaties
Humaan immunodeficiëntievirus (HIV)
Laatst beoordeeld: 04.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Het Acquired Immunodeficiency Syndrome (ACD) werd in 1981 in de Verenigde Staten als een specifieke ziekte geïdentificeerd, toen een aantal jongeren ernstige ziekten ontwikkelden, veroorzaakt door micro-organismen die niet-pathogeen of zwakpathogeen waren voor gezonde mensen. Een onderzoek naar de immuunstatus van patiënten toonde een scherpe daling aan van het aantal lymfocyten in het algemeen en T-helpercellen in het bijzonder. Deze aandoening werd aids (Acquired Immune Deficiency Syndrome) genoemd. De infectiemethode (seksueel contact, via bloed en bloedpreparaten) wees op het infectieuze karakter van de ziekte.
De verwekker van aids werd in 1983 onafhankelijk van elkaar ontdekt door de Fransman L. Montagnier, die het LAV Lymphoadenopathy Associated Virus noemde, omdat hij het had aangetroffen bij een patiënt met lymfadenopathie; en de Amerikaan R. Gallo, die het virus HTLV-III (Human T-lymphotropic Virus III) noemde: hij had eerder al de lymfotrope virussen I en II ontdekt.
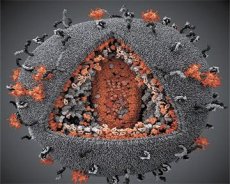
Een vergelijking van de eigenschappen van het LAV- en HTLV-III-virus toonde hun identiteit aan. Om verwarring te voorkomen, kreeg het virus in 1986 de naam HIV (Human Immunodeficiency Virus, of HIV). HIV is bolvormig met een diameter van 110 nm. De virusmantel heeft de vorm van een veelvlak, bestaande uit 12 vijfhoeken en 20 zeshoeken. In het midden en de hoeken van elke zeshoek bevindt zich een molecuul van het geglycosyleerde eiwit gpl20 (het getal 120 geeft het molecuulgewicht van het eiwit in kilodalton aan). In totaal bevinden zich 72 gpl20-moleculen op het oppervlak van het virion in de vorm van bijzondere spikes, die elk geassocieerd zijn met het intramembraaneiwit gp41. Deze eiwitten vormen samen met de dubbele lipidenlaag de supercapside (het membraan) van het virion.
De gpl20- en gp41-eiwitten worden gevormd door het Env-precursoreiwit te knippen door een cellulair protease. Het gp41-eiwit vormt de spike-"stam" door zich met zijn cytoplasmatisch domein te binden aan het matrixeiwit p17MA, dat zich direct onder de envelop bevindt. De p17-moleculen interageren tijdens de rijping van het virion en vormen een icosaëder onder de envelop.
In het centrale deel van het virion vormt het p24-eiwit een kegelvormige capside. Het vernauwde deel van de capside is verbonden met het virionmembraan met medewerking van het rb-eiwit. In de capside bevinden zich twee identieke moleculen viraal genomisch RNA. Deze zijn met hun 5'-uiteinden verbonden met het nucleocapside-eiwit p7NC. Dit eiwit is interessant omdat het twee aminozuren (motieven) bevat die rijk zijn aan cysteïne en histidine en een zinkatoom bevatten – ze worden "zinkvingers" genoemd omdat ze moleculen van genomisch RNA vangen en opnemen in de zich vormende virionen. De capside bevat ook drie enzymen. Revertase (RT), of pol-complex, omvat reverse transcriptase, RNase H en DNA-afhankelijk DNA-polymerase. Revertase is aanwezig als een heterodimeer p66/p51. Protease (PR) - p10, initieert en implementeert het proces van virionrijping. Integrase (IN) - p31, of endonuclease, zorgt voor de opname van proviraal DNA in het genoom van de gastheercel. De capside bevat ook een molecuul primer-RNA (tRNAl"3).
Het RNA-genoom in de cel wordt met behulp van reverse transcriptase omgezet in een DNA-genoom (DNA-provirus), bestaande uit 9283 nucleotideparen. Het wordt links en rechts begrensd door zogenaamde lange terminale herhalingen, of LTR's: S'-LTR links en 3'-LTR rechts. LTR's bevatten elk 638 nucleotideparen.
Het hiv-genoom bestaat uit 9 genen, waarvan sommige aan de uiteinden overlappen (meerdere leesramen hebben) en een exonintronstructuur hebben. Ze reguleren de synthese van 9 structurele en 6 regulerende eiwitten.
Het belang van LTR's voor het virale genoom is dat ze de volgende regulerende elementen bevatten die de werking ervan controleren:
- transcriptiesignaal (promotorregio);
- poly-A additiesignaal;
- capping signaal;
- integratiesignaal;
- positief regulatiesignaal (TAR voor TAT-eiwit);
- negatief regulerend element (NRE voor NEF-eiwit);
- een plaats voor de aanhechting van primer-RNA (tRNA™3) voor de synthese van minusstrengs-DNA aan het 3'-uiteinde; een signaal aan het 5'-uiteinde van de LTR dat dient als primer voor de synthese van plusstrengs-DNA.
Daarnaast bevat LTR elementen die betrokken zijn bij de regulatie van mRNA-splicing, het verpakken van vRNA-moleculen in de capside (Psi-element). Tot slot worden tijdens de transcriptie van het genoom twee signalen gevormd in lange mRNA's voor het REV-eiwit, die de eiwitsynthese schakelen: CAR - voor regulerende eiwitten en CRS - voor structurele eiwitten. Als het REV-eiwit aan CAR bindt, worden structurele eiwitten gesynthetiseerd; als het niet aanwezig is, worden alleen regulerende eiwitten gesynthetiseerd.
De volgende regulerende genen en hun eiwitten spelen een bijzonder belangrijke rol bij het reguleren van de werking van het virusgenoom:
- TAT-eiwit, dat de positieve controle van virale replicatie uitvoert en via de regulerende regio van TAR werkt;
- NEV- en VPU-eiwitten, die een negatieve controle uitoefenen op de replicatie via de NRE-regio;
- REV-eiwit, dat positief-negatieve controle uitvoert. REV-eiwit controleert de werking van gag-, pol- en env-genen en voert negatieve regulatie van splicing uit.
De replicatie van HIV staat dus onder drievoudige controle: positief, negatief en positief-negatief.
Het VIF-eiwit bepaalt de infectiviteit van het nieuw gesynthetiseerde virus. Het is gekoppeld aan het p24-capside-eiwit en is in het virion aanwezig in een hoeveelheid van 60 moleculen. Het NEF-eiwit wordt in het virion vertegenwoordigd door een klein aantal moleculen (5-10), mogelijk gekoppeld aan de envelop.
Het VPR-eiwit remt de celcyclus in de G2-fase, neemt deel aan het transport van pre-integratiecomplexen naar de celkern, activeert enkele virale en cellulaire genen en verhoogt de efficiëntie van virusreplicatie in monocyten en macrofagen. De locatie van de VPR-, TAT-, REV- en VPU-eiwitten in het virion is niet vastgesteld.
Naast de eigen eiwitten kan het virionmembraan ook eiwitten van de gastheercel bevatten. VPU- en VPR-eiwitten spelen een rol bij de regulatie van de virale voortplanting.
Antigene varianten van het humaan immunodeficiëntievirus (HIV)
Het humaan immunodeficiëntievirus (hiv) is zeer variabel. Zelfs uit het lichaam van één patiënt kunnen virusstammen worden geïsoleerd die significant verschillen in antigene eigenschappen. Deze variabiliteit wordt mogelijk gemaakt door de intensieve vernietiging van CD4+-cellen en een krachtige antilichaamrespons op hiv-infectie. Een nieuwe vorm van hiv, hiv-2, die biologisch gezien verwant is aan hiv-1, maar immunologisch verschilt, is geïsoleerd bij patiënten uit West-Afrika. De homologie van de primaire structuur van het genoom van deze virussen is 42%. Het DNA van provirus hiv-2 bevat 9671 bp en de LTR - 854 bp. HIV-2 werd vervolgens in andere delen van de wereld geïsoleerd. Er is geen kruisimmuniteit tussen hiv-1 en hiv-2. Er zijn twee grote vormen van hiv-1 bekend: O (Outlier) en M (Major); de laatste is onderverdeeld in 10 subtypen (AJ). Acht subtypen (AH) circuleren in Rusland.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Het mechanisme van de interactie van HIV met de cel
Nadat het virus het lichaam is binnengedrongen, valt het eerst cellen aan die de specifieke CD4-receptor bevatten. Deze receptor is in grote hoeveelheden aanwezig in T-helpers, in kleinere hoeveelheden in macrofagen en monocyten, en T-helpers zijn bijzonder gevoelig voor het virus.
Het humaan immunodeficiëntievirus (hiv) herkent CD4-receptoren met behulp van zijn gpl20-eiwit. De interactie van hiv met de cel verloopt volgens het volgende schema: receptorgemedieerde adsorptie -> gecoate pit -> gecoat vesikel -> lysosoom. Hierbij fuseert het virionmembraan met het lysosoommembraan en komt het nucleocapside, losgemaakt van het supercapside, het cytoplasma binnen; op weg naar de celkern wordt het vernietigd en komen genomisch RNA en bijbehorende kerncomponenten vrij. Vervolgens synthetiseert reverse transcriptase de min-DNA-streng op het virion-RNA, vervolgens vernietigt RNase H het virion-RNA en synthetiseert viraal DNA-polymerase de plus-DNA-streng. 5'-LTR en 3'-LTR worden gevormd aan de uiteinden van het DNA-provirus. Het DNA-provirus kan enige tijd in een inactieve vorm in de celkern blijven, maar wordt vroeg of laat met behulp van zijn integrase geïntegreerd in het chromosoom van de doelcel. Hierin blijft het provirus inactief totdat de betreffende T-lymfocyt wordt geactiveerd door microbiële antigenen of andere immunocompetente cellen. Activering van cellulaire DNA-transcriptie wordt gereguleerd door een speciale nucleaire factor (NF-kB). Het is een DNA-bindend eiwit en wordt in grote hoeveelheden geproduceerd tijdens de activering en proliferatie van T-lymfocyten en monocyten. Dit eiwit bindt zich aan bepaalde sequenties van cellulair DNA en vergelijkbare LTR-sequenties van het DNA-provirus en induceert de transcriptie van zowel cellulair DNA als DNA-provirus. Door de transcriptie van het DNA-provirus te induceren, bewerkstelligt het de overgang van het virus van een inactieve toestand naar een actieve toestand en daarmee van een persistente infectie naar een productieve. Het provirus kan zeer lang in een inactieve toestand blijven. Activering van het virus is een cruciaal moment in de interactie met de cel.
Vanaf het moment dat het virus de cel binnendringt, begint de periode van hiv-infectie – de dragerstatus van het virus, die 10 jaar of langer kan duren; en vanaf het moment dat het virus geactiveerd wordt, begint de ziekte – aids. Met behulp van zijn regulerende genen en hun producten begint het virus zich actief te vermenigvuldigen. TAT-eiwit kan de snelheid van virusreproductie met een factor 1000 verhogen. Virale transcriptie is complex. Het omvat de vorming van zowel volledig als subgenomisch mRNA, mRNA-splicing, en vervolgens de synthese van structurele en regulerende eiwitten.
De synthese van structurele eiwitten verloopt als volgt. Eerst wordt het Pr55Gag-precursorpolyproteïne (een eiwit met een molecuulgewicht van 55 kDa) gesynthetiseerd. Het bevat 4 hoofddomeinen: matrix (MA), capside (CA), nucleocapside (NC) en het rb-domein. Hieruit worden, door het knippen van Pr55Gag door het virale protease (het wordt zelf geknipt uit een ander precursoreiwit, Gag-Pol), respectievelijk de structurele eiwitten p17, p24, p7 en rb gevormd. De vorming van het Pr55Gag-polyproteïne is de belangrijkste voorwaarde voor de vorming van virale deeltjes. Het is dit eiwit dat het morfogeneseprogramma van het virion bepaalt. Het omvat achtereenvolgens de fasen van transport van het Gag-polyproteïne naar het plasmamembraan, interactie ermee en eiwit-eiwitinteracties tijdens de vorming van het virale deeltje en de knopvorming ervan. Pr55Gag wordt gesynthetiseerd op vrije polyribosomen; Eiwitmoleculen worden naar het membraan getransporteerd, waar ze worden verankerd door hun hydrofobe regio's. Het CA-domein speelt de hoofdrol bij het creëren van de natuurlijke conformatie van het Gag-eiwit. Het NC-domein zorgt ervoor dat twee moleculen genomisch RNA (met behulp van zijn "zinkvingers") worden opgenomen in de samenstelling van het zich vormende virale deeltje. Het polyproteïnemolecuul dimeriseert aanvankelijk door de interactie van de matrixdomeinen. Vervolgens combineren de dimeren zich tot hexamere complexen (van 6 eenheden) als gevolg van de interactie van het CA- en NC-domein. Uiteindelijk vormen de hexameren, die zich aan hun laterale oppervlakken verenigen, onrijpe bolvormige virionen, waarin zich het genomische virale RNA bevindt, gevangen door het NC-domein.
Een ander voorlopereiwit, Prl60Gag-Pol (een eiwit met een molecuulgewicht van 160 kDa), wordt gesynthetiseerd als gevolg van een frameshift door het ribosoom tijdens de translatie van het 3'-uiteinde van het gag-gen in het gebied direct stroomopwaarts van het gebied dat codeert voor het rb-eiwit. Dit Gag-Pol-polyproteïne bevat een onvolledige Gag-eiwitsequentie (1-423 aminozuren) en Pol-sequenties die de PR-, RT- en IN-domeinen omvatten. Gag-Pol-polyproteïnemoleculen worden ook gesynthetiseerd op vrije polyribosomen en worden naar het plasmamembraan getransporteerd. Het Prl60Gagpol-polyproteïne bevat alle intermoleculaire interactieplaatsen en membraanbindingsplaatsen die inherent zijn aan het Gag-polyproteïne. Daarom fuseren de Gag-Pol-polyproteïnemoleculen met het membraan en worden ze, samen met de Gag-moleculen, opgenomen in de vormende virionen, wat resulteert in het verschijnen van actieve protease en het begin van het virionrijpingsproces. HIV-1-protease is alleen zeer actief in de vorm van een dimeer. Dimerisatie van deze moleculen is daarom vereist voor zelfexcisie uit Prl60Gag-Pol. Virionrijping bestaat uit het feit dat het vrijgekomen actieve protease prl60Gag-Pol en Gag55 knipt op de door het protease herkende plaatsen; de eiwitten p17, p24, p7, p6, revertase en integrase worden gevormd en hun binding aan de virale structuur vindt plaats.
Het Env-eiwit wordt gesynthetiseerd op ribosomen die verbonden zijn met de membranen van het endoplasmatisch reticulum. Vervolgens wordt het geglycosyleerd, door een cellulair protease geknipt in gp120 en gp41, en naar het celoppervlak getransporteerd. In dit geval dringt gp41 door het membraan en bindt het zich aan de matrixdomeinen van het Gag-eiwitmolecuul dat verbonden is met het binnenoppervlak van het membraan. Deze verbinding blijft behouden in het volwassen virion.
De assemblage van virusdeeltjes bestaat dus uit de aggregatie van precursoreiwitten en bijbehorende RNA-moleculen op het plasmamembraan van de gastheercel, de vorming van onrijpe virionen en hun vrijlating door knopvorming van het celoppervlak. Tijdens knopvorming omringt het virion zich met een celmembraan waarin de gp41- en gp120-moleculen zijn ingebed. Tijdens knopvorming, of mogelijk na het vrijkomen van virionen, vindt hun rijping plaats. Deze rijping vindt plaats met behulp van een viraal protease en bestaat uit het proteolytisch knippen van de precursoreiwitten Pr55Gag en Prl60Gag-Pol in eiwitten van het volwassen virus en hun associatie in bepaalde structurele complexen. De hoofdrol in de processen van virale morfogenese wordt gespeeld door het precursorpolyproteïne Pr55Gag, dat het onrijpe virion organiseert en assembleert; het rijpingsproces wordt voltooid door een specifiek viraal protease.
Oorzaken van immunodeficiëntie
Een van de belangrijkste oorzaken van immunodeficiëntie bij hiv-infectie is de massale sterfte van T-helpers. Dit gebeurt als gevolg van de volgende factoren. Ten eerste sterven met het virus geïnfecteerde T-helpers door apoptose. Men vermoedt dat bij aidspatiënten virale replicatie, apoptose en een afname van het aantal T-helpers met elkaar verbonden zijn. Ten tweede herkennen en vernietigen T-killers T-cellen die met het virus geïnfecteerd zijn of geadsorbeerde gpl20-moleculen dragen, evenals met en zonder virus geïnfecteerde T-helpers, die symplasten (syncytium) vormen die bestaan uit enkele tientallen cellen (sommige sterven af als gevolg van de reproductie van virussen in deze cellen). Als gevolg van de vernietiging van een groot aantal T-helpers, is er een afname in de expressie van membraanreceptoren in B-lymfocyten tot interleukine-2, de synthese van verschillende interleukinen (groeifactoren en differentiatie van B-lymfocyten - IL-4, IL-5, IL-6, enz.) wordt verstoord, wat resulteert in een verstoring van de functie van het T-killersysteem. De activiteit van de complement- en macrofaagsystemen wordt onderdrukt. Macrofagen en monocyten die met het virus zijn geïnfecteerd, sterven niet lang af, maar ze zijn niet in staat het virus uit het lichaam te verwijderen. Ten slotte, vanwege de structurele en antigene gelijkenis van gpl20 met de receptoren van sommige epitheelcellen van het lichaam (inclusief trofoblastreceptoren die de transplantatie van HIV bemiddelen), worden antireceptorantilichamen met een breed werkingsspectrum gesynthetiseerd. Dergelijke antilichamen kunnen verschillende cellulaire receptoren blokkeren en het beloop van de ziekte compliceren bij auto-immuunziekten. Het gevolg van een hiv-infectie is de vernietiging van alle belangrijke schakels van het immuunsysteem. Zulke patiënten worden weerloos tegen een breed scala aan micro-organismen. Dit leidt tot de ontwikkeling van opportunistische infecties en tumoren. Patiënten met een hiv-infectie lopen een verhoogd risico op het ontwikkelen van ten minste drie soorten kanker: Kaposi-sarcoom; carcinoom (inclusief huidkanker); B-cellymfoom, dat ontstaat door de kwaadaardige transformatie van B-lymfocyten. HIV is echter niet alleen lymfocytotroop, maar ook neurotroop. Het dringt door in de cellen van het centrale zenuwstelsel (astrocyten) door zowel receptor-gemedieerde endocytose als fagocytose van virusgeïnfecteerde lymfoblasten door astrocyten. Wanneer het virus interageert met astrocyten, worden ook symplasten gevormd, die de verspreiding van de ziekteverwekker via intercellulaire kanalen vergemakkelijken. Het virus kan lange tijd in macrofagen en monocyten aanwezig blijven, waardoor ze dienen als reservoir en verspreider van het virus in het lichaam en alle weefsels kunnen binnendringen. Geïnfecteerde macrofagen spelen een belangrijke rol bij de introductie van hiv in het centrale zenuwstelsel en de schade die het aanricht. Bij 10% van de patiënten gaan de primaire klinische syndromen gepaard met schade aan het centrale zenuwstelsel en manifesteren ze zich als dementie. Mensen die met hiv besmet zijn, worden gekenmerkt door drie groepen ziekten: opportunistische infecties,tumorziekten en schade aan het centrale zenuwstelsel.
Epidemiologie van HIV-infectie
De bron van een hiv-infectie is alleen een persoon – een ziek persoon of een virusdrager. Het humaan immunodeficiëntievirus (hiv) zit in bloed, sperma en baarmoederhalsvocht; bij zogende moeders in de moedermelk. Besmetting vindt seksueel plaats, via bloed en bloedpreparaten, en van moeder op kind voor, tijdens en na de bevalling. Er zijn geen gevallen bekend van besmetting met het virus via voedsel, drank en insectenbeten.
Drugsverslaving draagt bij aan de verspreiding van aids. De incidentie van hiv neemt elk jaar toe. Volgens de WHO waren tussen 1980 en 2000 58 miljoen mensen besmet met hiv. Alleen al in 2000 raakten wereldwijd 5,3 miljoen mensen besmet en stierven 3 miljoen mensen aan aids. Op 1 januari 2004 waren er in Rusland 264 duizend hiv-geïnfecteerden geregistreerd. De helft van de met hiv besmette mensen overlijdt binnen 11-12 jaar na de infectie. Begin 2004 leefden ongeveer 180 van elke 100 duizend Russische burgers met de diagnose "hiv-infectie". Er wordt voorspeld dat met dit niveau van morbiditeit het totale aantal hiv-geïnfecteerden in Rusland in 2012 2,5-3 miljoen mensen zal bedragen. De complexiteit van de strijd tegen hiv-infectie hangt af van een aantal redenen: ten eerste zijn er geen effectieve behandelmethoden en specifieke preventie; Ten tweede kan de incubatietijd voor een hiv-infectie langer dan 10 jaar duren. De duur ervan hangt af van het moment van activering van de T-lymfocyt en het provirus-DNA dat zich in het chromosoom bevindt. Het is nog steeds onduidelijk of iedereen die met het virus besmet is gedoemd is tot aids of dat langdurige dragerschap van het virus zonder ziekte mogelijk is (wat onwaarschijnlijk lijkt). Ten slotte bestaan er verschillende humane immunodeficiëntievirussen (hiv-1, hiv-2), waarvan de antigene verschillen de vorming van kruisimmuniteit voorkomen. De ontdekking van het simian immunodeficiency virus (SIV) wierp licht op de vraag naar de oorsprong van hiv. SIV lijkt qua genoomorganisatie op hiv, maar verschilt aanzienlijk in zijn nucleotidevolgorde. HIV-2 neemt qua serologische eigenschappen een tussenpositie in tussen hiv-1 en SIV en lijkt qua nucleotidevolgorde meer op SIV. In dit verband suggereerde VM Zhdanov dat hiv-1-, hiv-2- en SIV-virussen afkomstig zijn van een gemeenschappelijke voorouder. Volgens R. Gallo is het mogelijk dat een van de SIV's op de een of andere manier in het menselijk lichaam terecht is gekomen, waar het een reeks mutaties heeft ondergaan die hebben geleid tot het ontstaan van HIV-1, HIV-2 en andere vormen daarvan.
Symptomen van een hiv-infectie
Het humaan immunodeficiëntievirus (HIM) heeft een aantal kenmerken die grotendeels de pathogenese van de ziekte bepalen. Het virus heeft een zeer hoge reproductiesnelheid, bepaald door zijn regulerende elementen (tot 5000 virionen worden in 5 minuten gesynthetiseerd in het actieve stadium). Door de aanwezigheid van het fusie-eiwit (gp41) induceert het virus de vorming van uitgebreide syncytiale structuren door de fusie van geïnfecteerde en niet-geïnfecteerde T-helpercellen, wat resulteert in hun massale dood. De in grote hoeveelheden gevormde gpl20-eiwitmoleculen circuleren vrij in het bloed en binden zich aan de receptoren van niet-geïnfecteerde T-helpercellen, waardoor ze ook door T-killers worden herkend en vernietigd. Het virus kan zich via intercellulaire kanalen van cel tot cel verspreiden, waardoor het moeilijk toegankelijk wordt voor antilichamen.
Klinische criteria voor HIV-infectie
Bij volwassenen wordt de diagnose hiv-infectie gesteld wanneer er sprake is van ten minste twee ernstige symptomen in combinatie met ten minste één licht symptoom en er geen andere bekende oorzaken van immunodeficiëntie zijn (kanker, aangeboren immunodeficiëntie, ernstige verhongering, enz.). Ernstige symptomen zijn onder meer:
- gewichtsverlies van 10% of meer;
- een langdurige koortsachtige toestand, met tussenpozen of constant;
- chronische diarree.
Lichte symptomen: aanhoudende hoest, gegeneraliseerde dermatitis, recidiverende herpes zoster, orale en faryngeale candidiasis, chronische herpes simplex, gegeneraliseerde lymfadenopathie. De diagnose aids wordt gesteld bij aanwezigheid van alleen Kaposi-sarcoom, cryptokokkenmeningitis en pneumocystispneumonie. Het klinische beeld van de ziekte wordt beïnvloed door de begeleidende opportunistische infectie.
Methoden voor het kweken van het humaan immunodeficiëntievirus (HIV)
HIV-1 en HIV-2 kunnen worden gekweekt in cellen van slechts één kloon TCV4-lymfocyten - H9, verkregen uit leukemische TCV4-lymfocyten. Monolaagculturen van astrocytcellen, waarin HIV-1 zich goed vermenigvuldigt, kunnen ook voor deze doeleinden worden gebruikt. Chimpansees zijn vatbaar voor HIV-1 onder dieren.
De resistentie van het virus in de buitenomgeving is laag. Het sterft onder invloed van zonlicht en uv-straling en wordt bij 80 °C binnen 30 minuten vernietigd, en bij behandeling met gangbare desinfectiemiddelen binnen 20-30 minuten. Om virusbevattend materiaal te desinfecteren, is het noodzakelijk om mycobactericide desinfectiemiddelen te gebruiken, omdat deze effectief zijn tegen micro-organismen met de hoogste resistentie.
Laboratoriumdiagnostiek van HIV-infectie
De belangrijkste methode voor het diagnosticeren van virusdragerschap en hiv-infectie is de enzymimmunoassay. Omdat gpl20 echter structurele en antigeengelijkenis vertoont met receptoren van sommige menselijke cellen, waaronder receptoren die immunoglobulinen transporteren door epitheelcellen van de slijmvliezen, kunnen antilichamen die gerelateerd zijn aan antilichamen tegen gpl20 in het lichaam voorkomen. In dit geval kunnen er vals-positieve ELISA-resultaten zijn. Daarom worden alle positief reagerende sera van de proefpersonen aanvullend geanalyseerd met behulp van de immunoblottingmethode, ook wel Western blotting genoemd. Deze methode is gebaseerd op de identificatie van de te onderzoeken antilichamen na hun elektroforetische scheiding en daaropvolgende tests met gelabelde anti-species-antilichamen. De virologische methode wordt zelden gebruikt vanwege de complexiteit van het kweken van het virus. De H9-lymfocytkloon wordt gebruikt om virale antigenen te verkrijgen - de noodzakelijke componenten van diagnostische testsystemen. De CPR-methode maakt het mogelijk om het virus in een vroeg stadium van viremie te detecteren.
Behandeling van HIV-infectie
Het is noodzakelijk om medicijnen te vinden of te synthetiseren die de activiteit van reverse transcriptase (revertase) of viraal protease effectief onderdrukken. Ze zouden de vorming van DNA-provirus voorkomen en/of de intracellulaire reproductie van het virus remmen. De moderne strategie voor de behandeling van hiv-geïnfecteerde patiënten is gebaseerd op het principe van gecombineerd gebruik van medicijnen die viraal protease (één van de medicijnen) en reversease (twee verschillende medicijnen) remmen - gecombineerde (drievoudige) therapie. In Rusland wordt voor de behandeling van hiv-geïnfecteerde patiënten het gecombineerde gebruik van twee binnenlandse medicijnen aanbevolen: fosfozide en crixivan. Deze medicijnen onderdrukken specifiek de hiv-reproductie in de vroege en late stadia van de voortplanting, met name met een verminderde activiteit van azidothymidine.
Het probleem van specifieke profylaxe is de noodzaak om een vaccin te ontwikkelen dat de vorming van effectieve celgemedieerde immuniteit garandeert op basis van virusspecifieke cytotoxische lymfocyten zonder significante productie van antilichamen. Deze immuniteit wordt geboden door Thl-helpers. Het is mogelijk dat antilichamen, waaronder virusneutraliserende, niet alleen ineffectief zijn in het onderdrukken van een hiv-infectie, maar dat ze in hoge mate de celgemedieerde immuniteit onderdrukken. Daarom moet een anti-hiv-vaccin allereerst aan twee belangrijke vereisten voldoen: a) absoluut veilig zijn en b) de activiteit van T-cytotoxische lymfocyten stimuleren. De effectiviteit van verschillende vaccinvarianten, verkregen uit gedode (geïnactiveerde) virussen en uit individuele antigenen met sterke beschermende eigenschappen, wordt onderzocht. Dergelijke antigenen kunnen ofwel uit de virionen zelf worden geïsoleerd of chemisch worden gesynthetiseerd. Er is een vaccin voorgesteld dat is ontwikkeld op basis van genetische modificatie. Het is een recombinant vacciniavirus met hiv-genen die verantwoordelijk zijn voor de synthese van antigenen met sterke immunogene eigenschappen. De vraag naar de effectiviteit van deze vaccins vergt aanzienlijke tijd vanwege de lange incubatietijd van hiv-infectie en de grote variabiliteit van de ziekteverwekker. De ontwikkeling van een zeer effectief vaccin tegen hiv is een urgent en fundamenteel probleem.

