Medisch expert van het artikel
Nieuwe publicaties
Osteoblastoclastoom
Laatst beoordeeld: 04.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
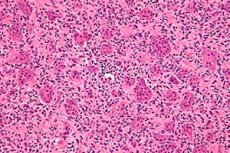
Het aantal gevallen van oncologische ziekten neemt wereldwijd voortdurend toe. Van de letsels van het skelet is osteoblastoclastoom (reuzenceltumor, osteoclastoom) het meest frequent – een goedaardig tumorproces dat vatbaar is voor maligniteit en in staat is om diverse skeletbotten te beschadigen. [ 1 ] Het primaire klinische beeld van de ziekte verloopt onopgemerkt, maar na verloop van tijd trekt zwelling van een afzonderlijk botgebied de aandacht: de tumor groeit geleidelijk en pijnloos. De behandeling van de pathologie is chirurgisch, waarbij het osteoblastoclastoom in gezond weefsel wordt verwijderd. Met tijdige behandeling wordt de uitkomst van de ziekte als bemoedigend beschouwd. [ 2 ]
Epidemiologie
De eerste gedetailleerde beschrijving van deze tumor werd gegeven door de Franse chirurg August Nelaton in de 19e eeuw. De vorming van reuzencellen werd ingedeeld in de categorie fibreuze osteodystrofieën. De pathologie werd met verschillende termen aangeduid: bruine tumor, gigantoom, osteoclastoom, lokale fibreuze osteodystrofie, reuzencelsarcoom. De naam osteoblastoclastoom werd in de medische terminologie geïntroduceerd door professor Rusakov.
Tegenwoordig twijfelen specialisten er niet meer aan dat osteoblastoclastoom, een van de meest voorkomende bottumoren, een tumor is die in de tumor zelf voorkomt. De ziekte komt bij mannen en vrouwen ongeveer even vaak voor. Er zijn beschrijvingen van familiale en erfelijke aandoeningen.
Osteoblastoclastoom kan zich op vrijwel elke leeftijd ontwikkelen. Er zijn gevallen bekend van tumordetectie bij zowel éénjarige baby's als 70-jarige ouderen. Volgens statistieken is bijna 60% van de patiënten met een dergelijke tumor tussen de 20 en 30 jaar oud.
Osteoblastoclastomen behoren tot de categorie solitaire tumoren, meestal enkelvoudig. Zeldzaam ontwikkelen dergelijke haarden zich in aangrenzend botweefsel. De laesie verspreidt zich meestal naar lange buisvormige botten (bijna 75% van de gevallen), en kleine en platte botten worden iets minder vaak aangetast.
Lange buisvormige botten worden voornamelijk in het epimetafysegebied aangetast (in de kindertijd in het metafysegebied). Tumorgroei in de weefsels van het gewrichts- en epifysair kraakbeen wordt niet waargenomen. Minder vaak treft de pathologie het diafysegebied (minder dan 1% van de gevallen).
Osteoblastoclastomen van de gezichtsbeenderen vormen ruim 20% van alle tumoren die op deze locatie worden gevonden.
Medisch specialisten maken onderscheid tussen maligne en benigne osteoblastoclastomen. Maligne pathologie komt zelden voor bij kinderen.
Oorzaken osteoclastomen
Artsen kunnen geen eenduidige oorzaak aanwijzen voor het ontstaan van osteoblastoclastoom. Men vermoedt dat het optreden van de pathologie beïnvloed kan worden door:
- ontstekingsprocessen die het bot en het beenvlies aantasten;
- traumatisch letsel of herhaaldelijk letsel aan hetzelfde botgebied;
- herhaalde bestralingen;
- verstoring van de botvorming tijdens de prenatale periode.
Bij ongeveer zeven op de tien gevallen tast het osteoblastoclastoom de lange buisvormige botten aan, maar het kan zich ook uitbreiden naar nabijgelegen pezen en zacht weefsel.
Als de pathologie zich ontwikkelt in de kaakstreek, is de oorzaak meestal een botletsel of een infectieus proces, bijvoorbeeld na het trekken of verwijderen van een tand. Minder vaak wordt een neoplasma vastgesteld in het gebied van de kuitbeen en scheenbeen, de ribben en de wervelkolom.
Vrouwen hebben vaak last van de handen, tenen, dijbenen en kniegewrichten, met de vorming van een diffuse tenosynoviale reuzenceltumor. Zo'n tumor ziet eruit als een dichte formatie tussen de weke delen, gelokaliseerd nabij de pezen. Geleidelijk verspreidt het proces zich naar het gewrichtsbot, waar het beschadigd en vernietigd wordt.
Over het algemeen worden de volgende oorzaken van osteoblastoclastoom beschouwd:
- veranderingen in de hormoonbalans;
- endocriene pathologieën;
- blootstelling aan beroepsrisico's, slechte gewoonten;
- slechte voeding;
- langdurig of onjuist gebruik van bepaalde medicijnen;
- parasitaire laesies;
- langdurig verblijf in radioactieve zones.
Transformatie van goedaardig osteoblastoclastoom naar kwaadaardige tumor is mogelijk onder invloed van:
- frequente verwondingen aan het pathologisch veranderde botsegment;
- sterke hormonale veranderingen (bijvoorbeeld tijdens de zwangerschap);
- herhaalde bestraling.
De hierboven genoemde factoren leiden niet noodzakelijkerwijs tot de ontwikkeling van pathologie, maar ze kunnen een negatieve impact hebben op mensen die vatbaar zijn voor de ontwikkeling van osteoblastoclastoom.
Risicofactoren
Osteoblastoclastoom ontwikkelt zich meestal bij patiënten ouder dan 10 jaar. Bij kinderen jonger dan 5 jaar is de pathologie zeer zeldzaam.
Het risico op het ontwikkelen van een tumor neemt toe onder invloed van de volgende factoren:
- Ongunstige omgevingsomstandigheden, de aanwezigheid van gevaren op het werk en thuis, vergiftigingen, chronische infectieziekten, parasitaire plagen.
- Voorgeschiedenis van oncologische pathologieën, eerdere radiotherapie (met name meerdere kuren), andere blootstelling aan straling (inclusief wonen of werken in radioactief gevaarlijke gebieden).
- Regelmatige verwondingen, breuken, kneuzingen en botbreuken.
- Genetische factoren, genveranderingen of -mutaties, kankerdiagnoses bij naaste familieleden.
- Aangeboren botafwijkingen, skeletafwijkingen.
Vaak wordt de omgevingsfactor niet als de belangrijkste oorzaak beschouwd, en volkomen tevergeefs: milieuproblemen hebben een directe impact op de luchtkwaliteit, voedselproducten en waterhuishouding in een gebied, wat steevast de gezondheid beïnvloedt. De schadelijke effecten van ultraviolette straling worden opgemerkt wanneer iemand langdurig en regelmatig stranden en open zwembaden bezoekt en daardoor verbrandt.
Ook in veel gevaarlijke industrieën waarbij chemicaliën als nikkel, asbest, zwavelzuur en arseen betrokken zijn, en bij de verwerking van metaal en kunststof, komen kankerverwekkende stoffen en straling voor.
Pathogenese
Een reuzenceltumor is een complexe histologisch goedaardige botlaesie die zelden terugkeert, hoewel het zeker een bron is van "goedaardige" metastasen en na bestraling vaak transformeert in een sarcoom. Bij gebrek aan een duidelijke histogenetische oorsprong wordt een reuzenceltumor genoemd naar zijn specifieke histologische uiterlijk.
De typische morfologische beschrijving is een goedaardige mononucleaire stromacellaesie met overvloedige goedaardige osteoclastachtige reuzencellen. Immunohistochemische en moleculaire studies van osteoclastoomweefsels tonen twee stromacelpopulaties aan, één bestaande uit prolifererende spindelcellen die markers van osteoblastische oorsprong vertegenwoordigen,[ 3 ],[ 4 ], terwijl de andere populatie bestaat uit polygonale cellen die kleuren voor CD14+/CD68+ monocyt/macrofaag-antigenen.[ 5 ]
De belangrijkste pathogenetische kenmerken van osteoblastoclastoom:
- De tumor bestaat uit twee celtypen: meerkernige reuzencellen en kleine mononucleaire cellen;
- het vaakst worden het distale deel van het dijbeen, het proximale deel van de scheenbeen, het distale deel van de spaakbeen, maar ook de bekkenbeenderen en het schouderblad aangetast (minder vaak de wervelkolom);
- de laesie is overwegend geïsoleerd en solitair;
- de tumor bevindt zich in de epifyse of metafyse, die sterk opzwelt en vervormt tot een grote knobbel of hemisfeer;
- het pathologische proces bereikt het gewrichtskraakbeen en wordt onderbroken;
- het neoplasma groeit in alle richtingen, maar de belangrijkste groei vindt plaats langs de lange botas in de richting van de diafyse;
- de transversale afmeting neemt diametraal meer dan driemaal toe;
- bij de cellulaire variant van osteoblastoclastoom bestaat het neoplasma uit kamers die van elkaar gescheiden zijn door volledige en gedeeltelijke barrières (zoals zeepsop of onregelmatige honingraten);
- er is sprake van divergentie van de cortex, zwelling van binnenuit, verdunning, zonder periostale lagen;
- indien het osteoblastoclastoom van aanzienlijke omvang is, dan wordt de cortex geresorbeerd; het neoplasma wordt omgeven door een dun omhulsel bestaande uit de wanden van de oppervlakkige kamers;
- bij de osteolytische variant is er geen kamerpatroon, het botdefect is homogeen;
- schotelvormig randdefect;
- er wordt resorptie van de corticale laag waargenomen, de korst wordt scherper op de schadelijn, zonder ondermijning of periostale lagen;
- het defect vertoont duidelijke contouren;
- Bij 12% van de patiënten worden pathologische fracturen waargenomen.
Osteoblastoclastomen tasten gebieden aan die rijk zijn aan myeloïde beenmerg. Vaak worden uitgesproken krommingen en verkorting van het bot vastgesteld, vooral in gevallen van late diagnose en behandeling. In de meeste gevallen is de tumor excentrisch gelokaliseerd, met vernietiging van de overgrote meerderheid van de botcondylen. Radiologisch gezien wordt de subchondrale botlaag bereikt. In bijna de helft van de gevallen is het gehele gewrichtsuiteinde van het bot aangetast, zwelt het op, wordt de corticale laag vernietigd en strekt de laesie zich uit tot voorbij de botgrenzen.
Tegenwoordig wordt osteoblastoclastoom zelden als een goedaardige tumor beschouwd: het wordt geclassificeerd als een agressieve neoplasie, voornamelijk vanwege de onvoorspelbaarheid en de grote kans op maligniteit.
Symptomen osteoclastomen
De klinische verschijnselen op kinderleeftijd en op oudere leeftijd zijn vrijwel hetzelfde. De eerste tekenen worden niet direct opgemerkt, omdat osteoblastoclastomen zich aanvankelijk latent ontwikkelen en pas bijna een jaar na het begin van de ontwikkeling kunnen worden vastgesteld.
Deskundigen verdelen de symptomen in algemene en lokale symptomen. Algemene symptomen gaan meestal gepaard met maligne osteoblastoclastomen, terwijl lokale symptomen aanwezig zijn bij goedaardige tumoren.
De algemene symptomen zijn niet afhankelijk van de locatie van het aangetaste bot:
- ernstige pijn in het gebied van tumorgroei;
- palpatie kraken, wat duidt op de groei van het neoplasma en vernietiging van het botsegment;
- het verschijnen van een netwerk van vaten boven de pathologische focus;
- een gestage toename van een opgeblazen gevoel;
- toenemende pijn naarmate de tumor groeit;
- aantasting van de spier- en gewrichtsfunctie in de buurt van het getroffen gebied;
- vergroting van nabijgelegen lymfeklieren;
- algemene malaise, vermoeidheid;
- verhoging van de lichaamstemperatuur;
- verlies van eetlust, gewichtsverlies;
- apathie, hulpeloosheid.
Lokale verschijnselen zijn 'gebonden' aan de locatie van het aangetaste bot. Als er bijvoorbeeld een osteoblastoclastoom ontstaat in een van de kaken, wordt de gezichtssymmetrie geleidelijk verstoord. De patiënt krijgt problemen met spreken en kauwen, en soms raken tanden los en vallen ze uit. In ernstige gevallen ontstaan necrotische gebieden en fistels.
90% van de reuzenceltumoren vertonen een typische epifysaire locatie. De tumor strekt zich vaak uit tot in het subchondrale bot van het gewricht of grenst zelfs aan het kraakbeen. Het gewricht en/of het kapsel zijn zelden betrokken. In het zeldzame geval dat een osteoclastoom bij een kind optreedt, bevindt de laesie zich hoogstwaarschijnlijk in de metafyse. [ 6 ], [ 7 ] De meest voorkomende locaties in aflopende volgorde zijn het distale femur, proximale tibia, distale radius en sacrum. [ 8 ] 50% van de osteoclastomen ontstaat in de knieregio. Andere veelvoorkomende locaties zijn de fibulakop, proximale femur en proximale humerus. Lokalisatie in het bekken is zeldzaam. [ 9 ], [ 10 ] Multicentriciteit, of het synchroon verschijnen van osteoclastomen op verschillende skeletlocaties, is bekend, maar is uiterst zeldzaam. [ 11 ], [ 12 ]
Als er zich een osteoblastoclastoom in de benen ontwikkelt, verandert het looppatroon van de patiënt. Na verloop van tijd atrofiëren de spieren van de beschadigde onderste ledematen en wordt het lopen moeilijk. In sommige gevallen treden dystrofische botuitgroeisels op, waardoor het bot dunner wordt. Pathologische fracturen treden op, gepaard gaande met ernstige pijn en weefselzwelling. Complicaties in de vorm van bloedingen, hematomen en necrose van de weke delen kunnen optreden.
Als een osteoblastoclastoom zich in het gebied van het opperarmbeen of het dijbeen ontwikkelt, zijn de motoriek van de vingerkootjes en de algehele functie van het aangedane been verstoord.
Wanneer de tumor kwaadaardig wordt, verslechtert de toestand van de patiënt. De volgende symptomen zijn opvallend:
- de pijn in het aangetaste botgebied neemt toe;
- het neoplasma groeit gestaag;
- botweefsel wordt vernietigd, het gebied van de vernietiging breidt zich uit;
- de tumorfocus verliest zijn duidelijke grenzen;
- de corticale laag wordt vernietigd.
Alleen een specialist kan dergelijke veranderingen zien bij het uitvoeren van instrumentele diagnostiek.
Benigne osteoblastoclastomen worden gekenmerkt door een geleidelijk latent of asymptomatisch beloop. Het pijnsyndroom treedt alleen op tijdens de progressie van de pathologie; na enkele maanden begint de patiënt uitstralende pijn te ervaren. Bij veel patiënten is de eerste indicatie van de ziekte een pathologische fractuur. Bij diagnose heeft ongeveer 12% van de patiënten met osteoclastoom momenteel een pathologische fractuur. [ 13 ], [ 14 ] Er wordt aangenomen dat de aanwezigheid van een pathologische fractuur duidt op een agressievere ziekte met een hoger risico op lokaal recidief en metastatische verspreiding. [ 15 ]
Wanneer een osteoblastoclastoom kwaadaardig wordt, wordt de voorheen nauwelijks zichtbare tumor pijnlijk en worden er tekenen van irritatie van de zenuwuiteinden waargenomen. Als de tumor primair kwaadaardig is, is er sprake van hevige, invaliderende pijn met een snel toenemend neurologisch beeld.
Osteoblastoclastoom bij kinderen
De klinische symptomen van verschillende vormen van benigne osteoblastoclastomen zijn vaak verschillend. Cystische vormen vertonen lange tijd geen symptomen en worden in 50% van de gevallen pas ontdekt na het ontstaan van een pathologische fractuur. Het tumorproces wordt gedetecteerd met ernstige intraossale weefselproliferatie, met het optreden van pijnsyndroom. De protrusie van een botsectie treedt alleen op bij uitgesproken proliferatie: de patiënt heeft een uitgebreid veneus netwerk en beperkte gewrichtsmobiliteit. De lytische vorm van osteoblastoclastomen wordt gekenmerkt door snellere groei, vroeg optredende pijn, maar contracturen komen minder vaak voor.
Meestal treft een osteoblastoclastoom tijdens de kindertijd de bovenste metafysen van de humerus en het femur. Minder vaak worden laesies gevonden in de onderste femorale metafyse, de tibia en de fibula. Bij de lytische vorm is vernietiging van het epifysair kraakbeen mogelijk met verdere verspreiding naar de epifyse, zonder penetratie van het gewricht (het gewrichtskraakbeen blijft intact). Bij de actieve cystische vorm wordt tumorgroei waargenomen in het centrale deel van de diafyse, met een sterke verdunning van de corticale laag en botzwelling.
Osteoblastoclastomen bij kinderen zijn meestal goedaardig, maar kunnen ook aanzienlijke botvernietiging veroorzaken. Wanneer het epifysair kraakbeen groeit, vertraagt de groei van het ledemaatgebied, wat kan leiden tot pathologische fracturen, pseudoartrose met een uitgesproken botdefect en pijnsyndroom.
Bij een maligne proces ontstaat een neoplasma van het osteogene sarcoomtype: snelle groei en uitgesproken botvernietiging zijn kenmerkend. Voor de differentiële diagnose ondergaan kinderen histologisch onderzoek.
Stages
Deskundigen maken onderscheid tussen de lytische en cellulair-trabeculaire stadia in de ontwikkeling van osteoblastoclastomen.
- De cellulair-trabeculaire fase wordt gekenmerkt door de vorming van haarden van botweefselvernietiging, gescheiden door schotten.
- Het lytische stadium wordt gekenmerkt door de vorming van een continue destructieve focus, die asymmetrisch gelokaliseerd is ten opzichte van de centrale botas. Naarmate het neoplasma groeit, kan het zich uitbreiden naar de gehele botdoorsnede.
Een typisch teken van osteoblastoclastoom is de scheiding van de destructieve focus van het gezonde deel van het bot. Het beenmergkanaal wordt van het neoplasma gescheiden door een sluitplaat.
Vormen
Afhankelijk van de klinische en radiologische informatie en morfologische kenmerken worden de volgende basistypen osteoblastoclastomen onderscheiden:
- Het cellulaire type wordt voornamelijk aangetroffen bij patiënten van middelbare leeftijd en ouderen. Het neoplasma ontwikkelt zich langzaam en openbaart zich uiteindelijk als een dichte zwelling met een nodulair oppervlak, die niet door gezond bot kan worden beperkt. Wanneer het zich in de kaak bevindt, krijgt dit een spoelvormige vorm. De positie van de tanden verandert niet. Het weefsel dat het cellulaire osteoblastoclastoom bedekt, heeft een bloedarm karakter. Radiografisch wordt een schaduw waargenomen van een groot aantal cystische en cellulaire formaties, van elkaar gescheiden door barrières. Er is geen reactie vanuit het periost.
- De cysteuze vorm van osteoblastoclastoom veroorzaakt aanvankelijk een pijnlijk gevoel. Bij palpatie van de tumor zijn sommige gebieden plooibaar en is het symptoom van "perkamentcrunch" te zien. Het bot boven de tumor wordt dunner en heeft een gladde, convexe, koepelvormige vorm. Op de röntgenfoto lijkt de laesie op een odontogene cyste of ameloblastoom.
- Lytische pathologie is relatief zeldzaam, vooral bij kinderen en adolescenten. Het neoplasma groeit vrij snel. Tegen de achtergrond van verdunning van de corticale laag treedt pijn op: eerst in rust, vervolgens bij palpatie van het getroffen gebied. Uitbreiding van het vaatnetwerk boven de tumorlocatie wordt opgemerkt. Wanneer de pathologische focus zich in de kaak bevindt, worden de tanden scheef en los. Pathologische fracturen zijn mogelijk. Een ongestructureerde zone van verlichting is zichtbaar op de röntgenfoto.
Afhankelijk van de mate van maligniteit wordt osteoblastoclastoom onderverdeeld in goedaardig (zonder cellulair atypisme), primair kwaadaardig en kwaadaardig (getransformeerd van een goedaardige tumor).
Afhankelijk van de lokalisatie worden de volgende soorten pathologie onderscheiden:
- De perifere vorm van osteoblastoclastoom op de bovenkaak vertoont geen bijzondere morfologische kenmerken en bevindt zich op het tandvlees.
- De centrale vorm bevindt zich in de botstructuur en heeft, in tegenstelling tot de perifere vorm, hemorragische zones, die de bruine tint van het neoplasma veroorzaken. De tumor wordt weergegeven als één conglomeraat.
- Osteoblastoom van de onderkaak bevindt zich in de dikte van het botweefsel, ter hoogte van de kiezen en premolaren. De groei van het neoplasma duurt meerdere jaren (gemiddeld 3-10 jaar) en gaat gepaard met een verstoring van de functie van het kaakgewricht.
- Een osteoblastoclastoom van de bovenkaak manifesteert zich door een uitstulping van de aangedane kaak, loszittende tanden en een asymmetrisch gezicht. De tumor groeit langzaam en pijnloos.
- Osteoblastoclastoom van het femur is de meest voorkomende lokalisatie, met schade aan de botgroeizone: het trochanter major, de femurhals en de femurkop. Minder vaak is de trochanter minor aangetast (geïsoleerd). De pathologie gaat gepaard met pijn, botdeformatie en pathologische fracturen.
- Osteoblastoclastoom van het darmbeen ontwikkelt zich meestal aan de basis. Het is ook mogelijk dat het Y-vormige kraakbeen wordt aangetast, met vernietiging van de horizontale tak van het schaambeen of de afdalende tak van het zitbeen. De pathologie is aanvankelijk asymptomatisch, maar treedt vervolgens pijn op bij inspanning en kreupelheid.
Complicaties en gevolgen
Het meest ongunstige gevolg van benigne osteoblastoclastoom is de maligniteit ervan. Maligne reuzenceltumoren zijn zeldzaam; een analyse van studies toonde een frequentie van 1,6% van de primaire maligniteiten en 2,4% van de secundaire maligniteiten. Er wordt infiltratieve groei gedetecteerd, de dichtstbijzijnde lymfeklieren worden aangetast en er kunnen uitzaaiingen optreden. [ 16 ]
Het maligne reuzencelosteoblastoom kan de volgende soorten metastasen produceren:
- heet (snel ontwikkelend, actief omringende weefsels vernietigend);
- koud (zonder specifieke ontwikkeling, gedurende lange tijd in een inactieve toestand bestaand, maar het vermogen hebbend om te transformeren in “warm”);
- stom (bestaand in een anabiotische anabiotische toestand en bij toeval ontdekt).
Maligne osteoblastoclastomen kunnen in drie varianten voorkomen:
- Een primaire kwaadaardige tumor behoudt de basisstructuur, maar er is sprake van atypische mononucleaire elementen en de aanwezigheid van mitose in deze elementen.
- Maligniteit van een primair goedaardige tumor met de ontwikkeling van spindelcel- of osteogeen sarcoom.
- Maligniteit na eerdere behandeling, met name na niet-radicale interventies of irrationele radiotherapie. In een dergelijke situatie ontstaat meestal een polymorf celsarcoom met longmetastasen.
Maligne osteoclastoom wordt over het algemeen beschouwd als een sarcoom van hoge graad; [ 17 ] gegevens uit onderzoeken suggereren echter dat maligne osteoclastoom zich gedraagt als een sarcoom van lage of gemiddelde graad. [ 18 ] Metastasen komen voor bij 1-9% van de patiënten met osteoblastoclastoom, en in eerdere onderzoeken is de incidentie van metastasen in verband gebracht met agressieve groei en lokale recidieven. [ 19 ], [ 20 ]
Na chirurgische ingrepen worden patiënten met beperkte of verloren arbeidsgeschiktheid ingedeeld in de juiste arbeidsongeschiktheidsgroep.
Diagnostics osteoclastomen
Om osteoblastoclastoom te diagnosticeren, zijn de volgende methoden nodig:
- het ondervragen van de patiënt, zorgvuldig onderzoek en palpatie van het aangetaste botgebied, bestudering van de anamnese;
- laboratorium- en instrumentele diagnostiek, morfologische studies.
Bij het vaststellen van de anamnese van de pathologie let de arts op de eerste manifestaties van de tumor, de aanwezigheid en aard van de pijn, eerdere ziekten en verwondingen, eerdere behandelingen en de algemene toestand. Het is ook belangrijk om de toestand van de urinewegen, het voortplantingsstelsel, de luchtwegen, de lever, de nieren en de lymfeklieren te verduidelijken en een echografie van de inwendige organen uit te voeren.
Absoluut alle patiënten krijgen bloed- en urineonderzoek voorgeschreven, waarbij eiwit en fracties, siaalzuren, fosfor en calcium worden bepaald. Het is noodzakelijk om de enzymatische activiteit van fosfatasen te bepalen, een difenyltest uit te voeren, C-reactief proteïne te evalueren, enz. Laboratoriumindicatoren voor bottumoren zijn meestal niet-specifiek, maar kunnen wel helpen bij de differentiële diagnostiek. Bij maligne osteoblastoclastomen zijn bijvoorbeeld veranderingen zoals leukocytose, versnelde bezinkingssnelheid (ESR), verlaagde bloedeiwit- en niet-hemoglobine-ijzerwaarden, verhoogde siaalzuren en alkalische fosfatase mogelijk. Oxyproline en hexokinase worden in de urine aangetroffen. Fosfor- en calciumwaarden in het bloedserum stijgen.
Conventionele onderzoeken naar verdenking op osteoblastoclastoom omvatten algemene en gerichte röntgenfoto's en tomografie. Röntgenfoto's maken een nauwkeurigere lokalisatie, omvang en aard van het ziekteproces mogelijk, en bepalen de verspreiding ervan naar omliggende organen en weefsels. Computertomografie maakt het mogelijk om diepe pathologische schade te onderzoeken en de omvang van de laesie in het bot te bepalen. Magnetische resonantiebeeldvorming (MRI) wordt echter als informatiever beschouwd: op basis van de tijdens het onderzoek verkregen informatie kunnen artsen een ruimtelijk beeld samenstellen, inclusief een driedimensionaal beeld.
Tijdens het morfologisch onderzoek wordt het materiaal verkregen tijdens aspiratie en trepanobiopsie, of de verwijderde botdelen samen met het osteoblastoclastoom, bestudeerd. Een punctiebiopsie wordt uitgevoerd met behulp van speciale naalden en de tumor wordt onder röntgendoorlichting gepuncteerd.
Bij röntgenonderzoek van de lange buisvormige botten wordt bij patiënten een osteolytische destructieve focus gevonden, excentrisch gelokaliseerd in de epifyseregio. Bij dynamische diagnostiek divergeert de pathologie naar het gewrichtskraakbeen, evenals naar de botmetafyse, en kan de gehele dwarsdoorsnede in beslag nemen (wat typisch is voor een osteoblastoclastoom van de fibulakop en de radius). De corticale laag is sterk verdund, gezwollen en er wordt vaak gedeeltelijke destructie vastgesteld. Bij een benigne proces is er geen periostale reactie. De grens tussen het neoplasma en de sponsachtige substantie is vaag en onduidelijk. In de overgrote meerderheid van de gevallen is de sclerotische grens afwezig.
Bij ruggenmergletsel bevindt de tumor zich in 80% van de gevallen in het wervellichaam. Het wervellichaam met de boog en de uitsteeksels kan aangetast zijn, soms zijn meerdere wervels, ribben en het sacro-iliacale gewricht bij het pathologische proces betrokken. Destructieve haarden kunnen een cellulaire of lytische structuur hebben.
Bij het bestuderen van gelaagde beelden op CT wordt een destructie van de boog met dwarsuitsteeksels vastgesteld, die op een gewone röntgenfoto niet zichtbaar is. Met behulp van MRI kunnen we de invloed van de tumor op het ruggenmerg onderzoeken. [ 21 ], [ 22 ]
Een primair maligne osteoblastoclastoom wordt op de röntgenfoto gedefinieerd als een lytisch destructief brandpunt met vage grenzen. In sommige gevallen is de structuur grofmazig. Er is sprake van "zwelling" van het aangetaste botgebied, ernstige verdunning van de corticale laag met daaropvolgende vernietiging. De corticale plaat is van binnenuit heterogeen. Een periostale reactie is mogelijk.
Bij maligne transformatie van een aanvankelijk benigne osteoblastoclastoom wordt een grove, fijnmazige of lytische structuur van de destructieve focus zichtbaar. Het aangetaste botgebied is "gezwollen", de corticale laag is zeer dun, met onregelmatige contouren aan de binnenkant. Corticale vernietiging is mogelijk. De periostale reactie (zwakke Codman-piek) heeft het karakter van een bulbaire periostitis.
Om mogelijke uitzaaiingen op te sporen, wordt echografie voorgeschreven. Daarmee kan de toestand van de inwendige organen worden onderzocht.
De laatste fase van de diagnostiek van bottumoren is histologische identificatie en cytologisch onderzoek van uitstrijkjes. Het materiaal wordt afgenomen via een biopsie (open of punctie).
Differentiële diagnose
Goedaardige osteoblastoclastomen moeten worden onderscheiden van alle pathologieën die op röntgenfoto's tekenen van een botcyste of weefsellysis vertonen. Dergelijke pathologieën omvatten:
- vezelachtige dysplasie;
- lytisch osteogeen sarcoom;
- bijschildklierosteodystrofie;
- focus van bottuberculose;
- aneurysmatische botcyste.
Bij grote en progressieve botlaesies moet men denken aan een osteoblastoclastoom. Deze tumor wordt gekenmerkt door de afwezigheid van omringend bot, een destructief proces vanuit de metafyse, en late penetratie van pathologie in de epifyse.
Het is alleen mogelijk om parathyroïde osteodystrofie te onderscheiden van osteoblastoclastoom met behulp van röntgenfoto's en biochemische onderzoeken.
Er kunnen moeilijkheden ontstaan bij de diagnose van osteoblastoclastoom van de lange buisvormige botten en bij het onderscheiden van de ziekte van osteogene sarcoom of cysteuze formaties (bot of aneurysma).
De lokalisatie van een aneurysmatische cyste is voornamelijk de diafyse of metafyse. Bij een excentrische lokalisatie van een dergelijke cyste wordt lokale botzwelling waargenomen, een dunne corticale laag: het neoplasma is uitgerekt langs het bot en kan kalkdeeltjes bevatten. Bij een centrale lokalisatie zwelt de metafyse of diafyse symmetrisch op, wat niet gebeurt bij een osteoblastoclastoom.
In de kindertijd kan osteoblastoclastoom verward worden met de monostotische vorm van fibreuze osteodysplasie. In deze situatie is het bot vervormd, verkort (soms verlengd), maar zwelt het niet op, zoals bij osteoblastoclastoom. Fibreuze osteodysplasie tast voornamelijk de metafyse en diafyse van de tubulaire botten aan. De corticale laag kan dikker worden en er ontstaan sclerotische gebieden rond de destructiezones. Het ontwikkelingsproces is pijnloos en traag.
Als het osteoblastoclastoom de onderkaak aantast, moet de pathologie worden onderscheiden van odontoom, botfibroom, adamantinoom en dentigerous cyste.
Met wie kun je contact opnemen?
Behandeling osteoclastomen
Het doel van de behandeling is om de morbiditeit te minimaliseren en de functionaliteit van het aangetaste bot te maximaliseren; traditioneel werd deze behandeling uitgevoerd door middel van intralesionale curettage met vulling van de holte. Nieuwere technieken zoals cementatie met botcement zijn bemoedigend omdat ze helpen bij de reconstructie en lokale recidieven verminderen. [ 23 ]
De enige manier om volledig van een osteoblastoclastoom af te komen is door middel van een operatie: de tumor wordt verwijderd, waardoor verdere schade aan het bot wordt voorkomen.
Kleine osteoblastoclastomen worden voorzichtig weggeschraapt met een speciale curette. Het ontstane botdefect wordt vervangen door middel van autotransplantatie. Bij grotere tumoren wordt botresectie uitgevoerd, gevolgd door plastische chirurgie. [ 24 ], [ 25 ], [ 26 ]
Vanwege het hoge percentage (25-50%) van lokale recidieven na curettage en bottransplantatie worden chirurgen aangemoedigd hun chirurgische procedures te verbeteren door gebruik te maken van chemische of fysieke adjuvantia zoals vloeibare stikstof, acrylcement, fenol, waterstofperoxide, lokale chemotherapie of radiotherapie.[ 27 ],[ 28 ] Uit onderzoek is gebleken dat lokale adjuvante therapie helpt bij het beheersen van het recidiefpercentage.[ 29 ]
Als de patiënt om welke reden dan ook gecontra-indiceerd is voor een chirurgische ingreep, wordt hem radiotherapie voorgeschreven. Met behulp van straling is het mogelijk de groei van het neoplasma te stoppen en de structuur ervan te vernietigen. [ 30 ]
Het is ook mogelijk om de volgende technieken te gebruiken:
- Intralesionale toediening van steroïden. Deze methode is relatief nieuw en wordt nog niet zo lang gebruikt. Door middel van injecties kunnen positieve resultaten worden bereikt bij kleine osteoblastoclastomen: de tumor neemt af. Soms wordt de laesie aan het einde van de behandeling radiopaakder in vergelijking met het omliggende botgebied.
- Introductie van alfa-interferon. Gebaseerd op de theorie van de vasculaire oorsprong van osteoblastoclastoom, hebben specialisten de injectie van alfa-interferon in de praktijk geïntroduceerd. Dit medicijn heeft een antiangiogeen effect - dat wil zeggen, het remt de groei van bloedvaten. Deze methode is effectief gebleken bij ongeveer 50% van de patiënten, maar wordt relatief zelden gebruikt vanwege het grote aantal bijwerkingen - zoals hoofdpijn, algehele verslechtering van de gezondheid, ernstige vermoeidheid en een verminderd vermogen om te werken.
Voor de behandeling van maligne (primair of secundair) osteoblastoclastomen wordt uitsluitend chirurgische ingrepen toegepast, waarbij de tumor samen met het bot wordt verwijderd. Voor en na de operatie krijgt de patiënt bestraling en chemotherapie voorgeschreven.
Inoperabele osteoclastomen (bijvoorbeeld sommige sacrale en pelviene tumoren) kunnen worden behandeld met transkatheter-embolisatie van hun bloedtoevoer.
- Anti-RANKL-therapie
Reuzencellen overexpresseren een belangrijke mediator in osteoclastogenese: de RANK-receptor, die op zijn beurt wordt gestimuleerd door het cytokine RANKL, dat wordt afgescheiden door stromacellen. Studies met denosumab, een monoklonaal antilichaam dat specifiek bindt aan RANKL, hebben indrukwekkende behandelresultaten opgeleverd, wat heeft geleid tot de goedkeuring ervan door de Amerikaanse Food and Drug Administration (FDA). [ 31 ], [ 32 ] Denosumab is primair bedoeld voor patiënten met een hoog risico op recidief na een initiële operatie en lokaal recidief.
Chirurgische behandeling
Uit diverse onderzoeken blijkt dat brede resectie gepaard gaat met een verminderd risico op lokale recidieven vergeleken met intralesionale curettage en de recidiefvrije overleving kan verhogen van 84% tot 100%.[ 33 ],[ 34 ],[ 35 ] Brede resectie gaat echter gepaard met een hoger percentage chirurgische complicaties en resulteert in een functionele beperking, waarvoor gewoonlijk reconstructie nodig is.[ 36 ],[ 37 ],[ 38 ]
Als het osteoblastoclastoom gelokaliseerd is in de lange buisvormige botten, kunnen de volgende chirurgische ingrepen worden gebruikt:
- Marginale verwijdering met allo- of autoplastiek wordt uitgevoerd bij benigne osteoblastoclastomen, die zich langzaam ontwikkelen en een cellulaire structuur hebben die zich aan de periferie van de epimetafyse bevindt. Fixatie met metalen schroeven is mogelijk.
- Als de tumor zich uitstrekt tot het diametrale midden van het bot, worden 2/3 van de condylus en een deel van de diafyse met het gewrichtsoppervlak verwijderd. Het defect wordt opgevuld met een kraakbeentransplantaat. Er worden sterke bouten en schroeven gebruikt. De verbinding van het allotransplantaat met de corticale laag van het ontvangende bot wordt schuin uitgevoerd om verzakking van het gewricht te voorkomen.
- Indien de epimetafyse vernietigd is of er sprake is van een pathologische fractuur, wordt een segmentale resectie met gewrichtsdisarticulatie en vervanging van het defect door een allotransplantaat uitgevoerd. Fixatie met een staaf op cement.
- Bij een pathologische fractuur en maligniteit van het osteoblastoclastoom in het proximale deel van het femur wordt een totale heupprothese uitgevoerd.
- Bij verwijdering van de articulaire eindsegmenten van het kniegewricht wordt een allo-hemiarticulaire transplantatie met sterke fixatie toegepast. Individuele totale endoprothesen met een verlengde titanium steel en aansluitende radiotherapie zijn mogelijk.
- Als de agressieve tumor zich in het distale uiteinde van de tibia bevindt, wordt resectie met osteoplastische artrodese van de enkel uitgevoerd. Bij schade aan de talus wordt botverwijdering met verlengingsartrodese volgens Zatsepin toegepast.
- Als de pathologische focus zich in de cervicale wervelkolom bevindt, wordt anterieure toegang tot de wervels toegepast. Anterolaterale toegang is mogelijk met zorgvuldige scheiding van de farynx en de voorzijde van de wervels ten opzichte van de schedelbasis.
- Op Th1 - Th2 - niveau wordt een anterieure benadering met schuine sternotomie naar de derde intercostale ruimte gebruikt. De vaten worden voorzichtig naar beneden verschoven. Als de laesie zich in de 3e tot en met 5e thoracale wervel bevindt, wordt een anterolaterale benadering en resectie van de derde rib uitgevoerd. Het schouderblad wordt naar achteren verschoven zonder de spieren af te snijden. Er kunnen problemen ontstaan bij het benaderen van de voorste oppervlakken van de bovenste sacrale wervels. Een anterolaterale retroperitoneale benadering rechts wordt gebruikt, met zorgvuldige scheiding van de vaten en de ureter.
- Indien ernstige vernietiging van de wervels wordt vastgesteld, of uitbreiding van de tumor naar de bogen in de thoracale en lumbosacrale wervelkolom, wordt transpediculair-translaminaire fixatie uitgevoerd met verwijdering van de aangetaste wervels en autoplastiek.
- Als het osteoblastoclastoom zich in het schaambeen en het zitbeen bevindt, wordt het aangetaste gebied binnen de grenzen van gezond weefsel verwijderd zonder bottransplantatie. Als de onder- en bovenkant van het acetabulum zijn aangetast, is verwijdering met daaropvolgende botplastische vervanging van het defect geïndiceerd.
- Als het sacrum en L5 vernietigd zijn, worden de aangetaste delen posterieur verwijderd en gestabiliseerd met transpediculaire fixatie. Het neoplasma wordt vervolgens retroperitoneaal verwijderd, gevolgd door bottransplantaat.
Het voorkomen
Er zijn geen specifieke preventieve maatregelen om osteoblastoclastomen te voorkomen. Ter preventie adviseren specialisten om regelmatig, om de 1-2 jaar, röntgenonderzoek te laten doen om dergelijke tumoren snel op te sporen en te behandelen.
Als iemand een botverdichting constateert, moet hij of zij onmiddellijk een arts raadplegen: een therapeut, orthopedist, oncoloog, traumatoloog of vertebroloog.
Aanvullende medische aanbevelingen zijn onder meer:
- vermijd verwondingen en vergiftigingen, eet goed en voedzaam, wees fysiek actief;
- raadpleeg tijdig een arts, ook bij ziekten van het bewegingsapparaat;
- Als er een nieuwe tumor van onbekende oorsprong verschijnt, moet u zeker een arts raadplegen en een diagnostisch onderzoek laten uitvoeren.
Prognose
Bij patiënten met osteoblastoclastoom hangt de prognose van de ziekte af van vele factoren, zoals de kenmerken van de tumorontwikkeling, de maligniteit of benigne aard, de lokalisatie, de verspreiding, de tijdigheid van de behandeling, enz. De laatste jaren zijn de resultaten van de behandeling van kwaadaardige bottumoren aanzienlijk progressiever geworden. Artsen gebruiken een gecombineerde aanpak, indien nodig met intensieve polychemotherapie. Tegelijkertijd ligt het percentage volledig herstelde patiënten boven de 70%.
Deskundigen stellen dat de prognose positief is als het osteoblastoclastoom volledig operatief wordt verwijderd en er geen recidieven optreden. Chirurgen proberen, waar mogelijk, orgaanbehoudende operaties altijd uit te voeren met gelijktijdige bottransplantatie, en slechts in enkele gevallen is er sprake van mutilerende ingrepen, waarna iemand bepaalde handelingen niet meer kan uitvoeren: men moet zijn levensstijl aanpassen. In dergelijke situaties verstaan artsen de term 'herstel' als 'de afwezigheid van tumorprocessen'. Dergelijke patiënten hebben vervolgens langdurige revalidatie, orthopedische en soms psychologische begeleiding nodig.

