Medisch expert van het artikel
Nieuwe publicaties
Pathogenese van hepatitis B
Laatst beoordeeld: 07.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Bij de pathogenese van hepatitis B kunnen we een aantal belangrijke schakels in de pathogenische keten onderscheiden:
- introductie van de ziekteverwekker - infectie;
- fixatie op de hepatocyt en penetratie in de cel;
- vermenigvuldiging van het virus en de ‘uitdrijving’ ervan naar het oppervlak van de hepatocyt, alsook in het bloed;
- activering van immunologische reacties gericht op het elimineren van de ziekteverwekker;
- schade aan organen en systemen door het immuunsysteem;
- vorming van immuniteit, bevrijding van de ziekteverwekker, herstel.
Omdat infectie met hepatitis B altijd parenteraal plaatsvindt, kan worden aangenomen dat het moment van infectie vrijwel gelijk is aan de penetratie van het virus in het bloed. Pogingen van sommige onderzoekers om enterale en regionale fasen bij hepatitis B te onderscheiden, zijn slecht onderbouwd. Er zijn meer redenen om aan te nemen dat het virus direct via de bloedstroom de lever binnendringt.
De tropisme van het hepatitis B-virus naar leverweefsel wordt vooraf bepaald door de aanwezigheid van een speciale receptor in het HBsAg - een polypeptide met een moleculair gewicht van 31.000 Da (P31) dat albuminebindende activiteit heeft. Een vergelijkbare albuminezone wordt ook aangetroffen op het membraan van hepatocyten in de lever van mensen en chimpansees, wat in wezen de tropisme van HBV naar de lever van mensen en chimpansees bepaalt.
Wanneer het virus de hepatocyt binnendringt, komt viraal DNA vrij, dat de kern van de hepatocyt binnendringt en als matrix fungeert voor de synthese van nucleïnezuren. Dit activeert een reeks opeenvolgende biologische reacties, met als resultaat de vorming van de nucleocapside van het virus. De nucleocapside migreert door het kernmembraan naar het cytoplasma, waar de uiteindelijke vorming van Dane-deeltjes - het complete hepatitis B-virus - plaatsvindt.
Opgemerkt moet echter worden dat wanneer een hepatocyt geïnfecteerd is, het proces op twee manieren kan verlopen: replicatief en integratief. In het eerste geval ontstaat er een beeld van acute of chronische hepatitis, en in het tweede geval van virusdragerschap.
De redenen die de twee soorten interactie tussen viraal DNA en hepatocyten bepalen, zijn nog niet precies vastgesteld. Hoogstwaarschijnlijk is het type reactie genetisch bepaald.
Het resultaat van replicatieve interactie is de assemblage van de kernantigeenstructuren (in de celkern) en de assemblage van het complete virus (in het cytoplasma), gevolgd door de presentatie van het complete virus of zijn antigenen op het membraan of in de structuur van het hepatocytmembraan.
Het is algemeen aanvaard dat virusreplicatie niet leidt tot celschade op hepatocytniveau, aangezien het hepatitis B-virus geen cytopathisch effect heeft. Deze stelling kan niet als onomstotelijk worden beschouwd, aangezien deze gebaseerd is op experimentele gegevens die, hoewel ze wijzen op de afwezigheid van een cytopathisch effect van het hepatitis B-virus, werden verkregen op weefselkweken en daarom niet volledig kunnen worden geëxtrapoleerd naar virale hepatitis B bij mensen. In ieder geval vereist de kwestie van de afwezigheid van hepatocytschade tijdens de replicatieve fase aanvullend onderzoek.
Ongeacht de aard van de interactie tussen het virus en de cel, is de lever echter noodzakelijkerwijs betrokken bij het immunopathologische proces. In dit geval hangt de schade aan hepatocyten samen met het feit dat, als gevolg van de expressie van virale antigenen op het hepatocytenmembraan en de afgifte van virale antigenen in de vrije circulatie, een keten van opeenvolgende cellulaire en humorale immuunreacties ontstaat, die uiteindelijk gericht zijn op de verwijdering van het virus uit het lichaam. Dit proces verloopt volledig in overeenstemming met de algemene patronen van de immuunrespons op virale infecties. Om de ziekteverwekker te elimineren, worden cellulaire cytotoxische reacties uitgevoerd, gemedieerd door verschillende klassen effectorcellen: K-cellen, T-cellen, natural killers en macrofagen. Tijdens deze reacties worden de geïnfecteerde hepatocyten vernietigd, wat gepaard gaat met de afgifte van virale antigenen (HBcAg, HBeAg, HBsAg), die het antilichaamgenesesysteem activeren, waardoor specifieke antilichamen zich in het bloed ophopen, voornamelijk tegen de kern - anti-HBc en e-antigeen - anti-HBE. Vervolgens vindt er een vrijlating van de levercel van het virus plaats in het proces van zijn dood, als gevolg van de reacties van cellulaire cytolyse.
Tegelijkertijd binden specifieke antilichamen die zich in het bloed ophopen zich aan de virusantigenen en vormen immuuncomplexen die door macrofagen worden gefagocyteerd en door de nieren worden uitgescheiden. In dit geval kunnen verschillende immuuncomplexlaesies optreden in de vorm van glomerulonefritis, arteriitis, artralgie, huiduitslag, enz. Door de deelname van specifieke antilichamen wordt het lichaam gereinigd van de ziekteverwekker en treedt volledig herstel op.
Volgens het geschetste concept van de pathogenese van hepatitis B wordt de diversiteit aan klinische varianten van het beloop van de ziekte doorgaans verklaard door de specifieke kenmerken van de interactie tussen het virus en de samenwerking van immunocompetente cellen, met andere woorden, de sterkte van de immuunrespons op de aanwezigheid van virale antigenen. Volgens moderne concepten is de sterkte van de immuunrespons genetisch bepaald en gekoppeld aan de histocompatibiliteitsantigenen van de HLA-locus van de eerste klasse.
Het is algemeen aanvaard dat acute hepatitis zich klinisch ontwikkelt met een cyclisch verloop en volledig herstel, onder omstandigheden van een adequate immuunrespons op virusantigenen. Tegen de achtergrond van een afname van de immuunrespons op virusantigenen treedt immuungemedieerde cytolyse in geringe mate op. Er is dus geen effectieve eliminatie van geïnfecteerde levercellen, wat leidt tot milde klinische manifestaties bij langdurige persistentie van het virus en mogelijk de ontwikkeling van chronische hepatitis. Tegelijkertijd ontstaan er, in het geval van een genetisch bepaalde sterke immuunrespons en een massale infectie (hemotransfusie), uitgebreide gebieden met levercelschade, die klinisch overeenkomen met ernstige en kwaadaardige vormen van de ziekte.
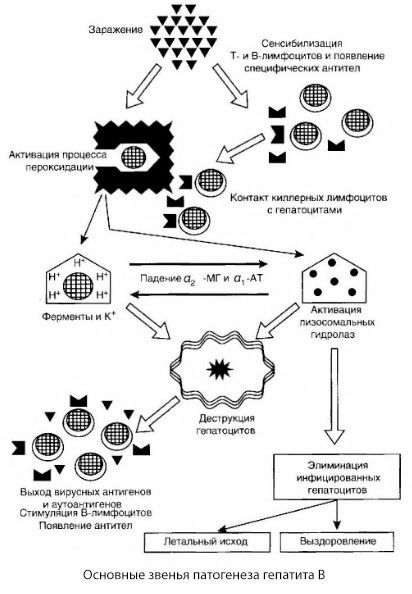
Het gepresenteerde schema van de pathogenese van hepatitis B onderscheidt zich door zijn samenhang; het bevat echter ook een aantal controversiële en weinig onderzochte punten.
Als we het concept van hepatitis B als een immunopathologische ziekte volgen, kunnen we een toename van cellulaire cytotoxische reacties verwachten met toenemende ernst van de ziekte. Bij ernstige vormen zijn de indices van de cellulaire immuniteitsband echter sterk verminderd, inclusief een meervoudige daling, vergeleken met die bij gezonde kinderen, en de K-cel cytotoxiciteitsindex. Bij de maligne vorm, tijdens de ontwikkeling van massale levernecrose en met name hepatisch coma, wordt een volledig onvermogen van lymfocyten tot blasttransformatie onder invloed van fytohematlutinine, stafylokokkenendotoxine en HBsAg opgemerkt. Bovendien is er geen vermogen van leukocyten om te migreren volgens de leukocytenmigratie-inhibitiereactie (LMIC), en wordt een sterke toename van de permeabiliteit van lymfocytmembranen aangetoond volgens de resultaten van hun studies met een fluorescerende tetracyclinesonde.
Als de fluorescentie-indices van lymfocyten bij gezonde mensen 9,9 ± 2% bedragen, en bij typische hepatitis B met een goedaardig beloop oplopen tot 22,3 ± 2,7%, dan bereikt het aantal fluorescerende lymfocyten bij kwaadaardige vormen gemiddeld 63,5 ± 5,8%. Aangezien een verhoogde permeabiliteit van celmembranen in de literatuur ondubbelzinnig wordt beoordeeld als een betrouwbare indicator van hun functionele inferioriteit, kan worden geconcludeerd dat er bij hepatitis B, met name in de kwaadaardige vorm, sprake is van ernstige schade aan lymfocyten. Dit blijkt ook uit de indices van K-celcytotoxiciteit. Bij de ernstige vorm bedraagt de cytotoxiciteit in de 1e-2e week van de ziekte 15,5±8,8%, bij de kwaadaardige vorm is dit in de 1e week 6,0±2,6% en in de 2e week 22,0±6,3% met een norm van 44,8±2,6%.
De gepresenteerde gegevens wijzen duidelijk op uitgesproken verstoringen in de cellulaire verbinding van de immuniteit bij patiënten met ernstige vormen van hepatitis B. Het is ook duidelijk dat deze veranderingen secundair optreden, als gevolg van beschadiging van immuuncompetente cellen door toxische metabolieten en mogelijk circulerende immuuncomplexen.
Uit onderzoek is gebleken dat bij patiënten met ernstige vormen van hepatitis B, met name bij de ontwikkeling van massale levernecrose, de titer van HBsAg en HBeAg in het bloedserum afneemt en dat tegelijkertijd antilichamen tegen het oppervlakteantigeen in hoge titers worden gedetecteerd. Dit is volkomen ongebruikelijk voor goedaardige vormen van de ziekte, waarbij anti-HBV pas in de 3e tot 5e maand van de ziekte verschijnen.
Het snelle verdwijnen van hepatitis B-virusantigenen en het gelijktijdig verschijnen van hoge titers antivirale antilichamen wijst op de intensieve vorming van immuuncomplexen en hun mogelijke deelname aan de pathogenese van de ontwikkeling van massale levernecrose.
De feitelijke gegevens laten ons dus niet toe om hepatitis B eenduidig te interpreteren, enkel vanuit het perspectief van immunopathologische agressie. En het punt is niet alleen dat er geen verband wordt gevonden tussen de diepte en prevalentie van morfologische veranderingen in de lever enerzijds en de ernst van cellulaire immuniteitsfactoren anderzijds. Theoretisch gezien zou deze omstandigheid verklaard kunnen worden door de late stadia van de studie van cellulaire immuniteitsindicatoren, toen immunocompetente cellen werden blootgesteld aan krachtige toxische effecten als gevolg van toenemende functionele insufficiëntie van de lever. Uiteraard kan worden aangenomen dat immuuncytolyse van hepatocyten plaatsvindt in de vroegste stadia van het infectieproces, mogelijk zelfs vóór het optreden van klinische symptomen van ernstige leverschade. Een dergelijke veronderstelling is echter onwaarschijnlijk, aangezien soortgelijke indicatoren van cellulaire immuniteit werden gedetecteerd bij patiënten met het meest acute (bliksem)beloop van de ziekte en bovendien bij morfologisch onderzoek van leverweefsel geen massale lymfocytaire infiltratie werd gedetecteerd, terwijl tegelijkertijd continue velden van necrotisch epitheel werden gedetecteerd zonder de verschijnselen van resorptie en lymfocytaire agressie.
Het is zeer moeilijk om het morfologische beeld van acute hepatitis uitsluitend vanuit het standpunt van immuuncellulaire cytolyse te verklaren. Daarom werd in vroege studies het cytotoxische effect van het hepatitis B-virus niet uitgesloten.
Deze veronderstelling is momenteel gedeeltelijk bevestigd door de ontdekking van het hepatitis B-virus. Studies hebben aangetoond dat de frequentie waarmee hepatitis D-markers worden gedetecteerd, direct afhankelijk is van de ernst van de ziekte: bij milde vormen worden ze aangetroffen bij 14%, matige bij 18%, ernstige bij 30% en kwaadaardige bij 52% van de patiënten. Aangezien het hepatitis D-virus een necrosogene cytopathische werking heeft, kan worden aangenomen dat co-infectie met hepatitis B- en D-virussen van groot belang is bij de ontwikkeling van fulminante vormen van hepatitis B.
De pathogenese van hepatitis B kan als volgt worden gepresenteerd. Nadat het hepatitis B-virus in hepatocyten is binnengedrongen, wordt een immunologische aanval op de geïnfecteerde hepatocyten geïnduceerd door T-killers, die lymfotoxinen afscheiden in de richting van levercellen.
De precieze mechanismen van hepatocytenschade bij hepatitis B zijn nog niet vastgesteld. De hoofdrol wordt gespeeld door geactiveerde processen van lipideperoxidatie en lysosomale hydrolasen. De trigger kan lymfotoxinen zijn die vrijkomen uit effectorcellen bij contact met hepatocyten, maar het is ook mogelijk dat het virus zelf de initiator is van peroxidatieprocessen. Vervolgens ontwikkelt het pathologische proces zich hoogstwaarschijnlijk in de volgende volgorde.
- Interactie van de agressiefactor (lymfotoxinen of virus) met biologische macromoleculen (mogelijk met bestanddelen van het endoplasmatisch reticulum die in staat zijn om deel te nemen aan ontgiftingsprocessen, naar analogie van andere schadelijke stoffen, zoals werd aangetoond in relatie tot tetrachloorkoolstof).
- Vorming van vrije radicalen, activering van lipidperoxidatieprocessen en verhoogde permeabiliteit van alle hepatocellulaire membranen (cytolysesyndroom).
- Verplaatsing van biologisch actieve stoffen langs de concentratiegradiënt - verlies van enzymen van verschillende intracellulaire lokalisaties, energiedonoren, kalium, enz. Ophoping van natrium en calcium in cellen, verschuiving van de pH-waarde richting intracellulaire acidose.
- Activering en afgifte van lysosomale hydrolasen (RNAse, DNAse, cathepsinen, enz.) met de afbraak van levercellen en de afgifte van autoantigenen.
- Stimulatie van het T- en B-immuunsysteem met de vorming van specifieke sensibilisatie van T-lymfocyten voor leverlipoproteïne en de vorming van antihepatische humorale auto-antilichamen.
In het voorgestelde schema van de pathogenese van hepatitis B zijn de triggerende factor virale antigenen, waarvan de intensieve productie wordt waargenomen in de vroegste stadia van de ziekte en gedurende de gehele acute periode, met uitzondering van kwaadaardige vormen, waarbij de productie van virale antigenen praktisch stopt op het moment dat zich massale levernecrose ontwikkelt, wat een snelle afname van de virale replicatie voorspelt.
Het is ook duidelijk dat virale antigenen de T- en B-systemen van de immuniteit activeren. Tijdens dit proces vindt een karakteristieke herverdeling van T-lymfocytensubpopulaties plaats, gericht op het organiseren van een adequate immuunrespons, het elimineren van geïnfecteerde hepatocyten, het neutraliseren van virale antigenen, sanogenese en herstel.
Wanneer immunocompetente cellen interacteren met virale antigenen op hepatocytmembranen of tijdens de virusreproductie in een hepatocyt, ontstaan er omstandigheden voor de activering van lipideperoxidatieprocessen, die, zoals bekend, de permeabiliteit van alle cellulaire en subcellulaire membranen controleren.
Vanuit dit standpunt wordt het optreden van het cytolysesyndroom, een verhoogde permeabiliteit van de celmembranen die zo natuurlijk en kenmerkend is voor virale hepatitis, begrijpelijk.
De uiteindelijke uitkomst van het cytolysesyndroom kan een volledige ontkoppeling van de oxidatieve fosforylering, lekkage van celmateriaal en de dood van het leverparenchym zijn.
In de overgrote meerderheid van de gevallen verlopen deze processen echter niet zo fataal. Alleen bij kwaadaardige vormen van de ziekte verloopt het pathologische proces lawine-achtig en onomkeerbaar, aangezien er massale infectie, een sterk immuunproces, overmatige activering van peroxidatieprocessen en lysosomale hydrodases en auto-immuunagressie optreden.
Dezelfde mechanismen worden waargenomen bij het gunstige beloop van hepatitis B, met als enige bijzonderheid dat ze allemaal op een kwalitatief verschillend niveau worden gerealiseerd. In tegenstelling tot gevallen van massale levernecrose is bij het gunstige beloop van de ziekte het aantal geïnfecteerde hepatocyten, en dus de zone van immunopathologische cytolyse, kleiner, zijn de processen van lipideperoxidatie niet zo significant versterkt, leidt de activering van zure hydrolasen slechts tot beperkte autolyse met een onbeduidende afgifte van autoantigenen, en daarom, zonder massale autoagressie, dat wil zeggen dat alle stadia van de pathogenese bij het gunstige beloop zich afspelen binnen het kader van de behouden structurele organisatie van het leverparenchym en worden geremd door afweersystemen (antioxidanten, inhibitoren, enz.) en daarom niet zo'n destructief effect hebben.
De oorzaken van intoxicatiesymptomen bij virale hepatitis zijn nog niet volledig onderzocht. Het voorstel om onderscheid te maken tussen de zogenaamde primaire, of virale, intoxicatie en secundaire (uitwisselings- of metabole) intoxicatie kan als positief worden beschouwd, hoewel dit het precieze mechanisme van het optreden van het algemene toxisch syndroom niet onthult. Ten eerste hebben hepatitisvirussen geen toxische eigenschappen, en ten tweede correleert de concentratie van veel metabolieten niet altijd met de ernst van de ziekte en de mate van expressie van toxicosesymptomen. Het is ook bekend dat de concentratie van virale antigenen niet strikt correleert met de ernst van de intoxicatie. Integendeel, met een toename van de ernst van de ziekte, en dus met een toename van de mate van toxicose, neemt de concentratie HBsAg af en is deze het laagst bij maligne vormen ten tijde van het begin van een diep hepatisch coma. Tegelijkertijd zijn de detectiefrequentie en titers van specifieke antivirale antilichamen direct afhankelijk van de ernst van de ziekte.
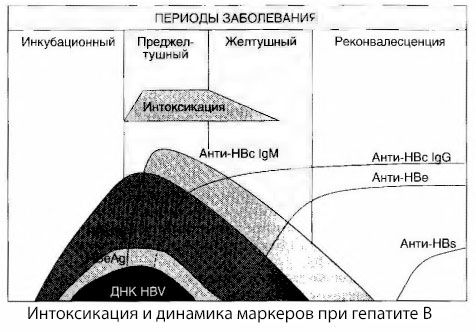
Intoxicatie treedt niet op bij de registratie van virale antigenen, maar tijdens de circulatie in het bloed van antivirale antilichamen van klasse IgM tegen het koeienantigeen en het antigeen van het E-systeem. Bovendien heeft een aanzienlijk deel van de patiënten bij ernstige en vooral kwaadaardige vormen zelfs anti-HBs in het bloed, wat bij milde en matige vormen van de ziekte meestal niet wordt waargenomen.
De gepresenteerde gegevens laten ons concluderen dat het toxicosesyndroom bij virale hepatitis, en hepatitis B in het bijzonder, niet ontstaat door het verschijnen van virale antigenen in het bloed, maar door de interactie van virale antigenen met antivirale antilichamen van de IgM-klasse. Het resultaat van een dergelijke interactie is, zoals bekend, de vorming van immuuncomplexen en mogelijk actieve toxische stoffen.
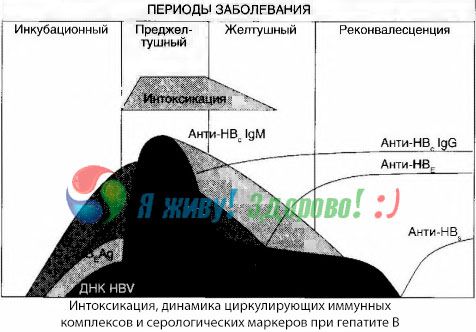
Symptomen van intoxicatie ontstaan op het moment dat immuuncomplexen in de vrije circulatie verschijnen, maar daarna wordt een dergelijk verband niet meer waargenomen.
Een gedeeltelijke verklaring hiervoor is te vinden in de studie van de samenstelling van immuuncomplexen. Bij patiënten met ernstige vormen circuleren er overwegend middelgrote complexen in het bloed, en in hun samenstelling overheersen op het hoogtepunt van het toxische syndroom antilichamen van de klasse, terwijl tijdens de periode van afname van klinische manifestaties en herstel de complexen groter worden en in hun samenstelling antilichamen van de IgG-klasse beginnen te overheersen.
De gepresenteerde gegevens hebben betrekking op de mechanismen van ontwikkeling van het toxisch syndroom in de beginperiode van de ziekte, maar bij toxicose die optreedt op het hoogtepunt van de klinische manifestaties, hebben ze slechts gedeeltelijke betekenis, en vooral bij de ontwikkeling van levercoma.
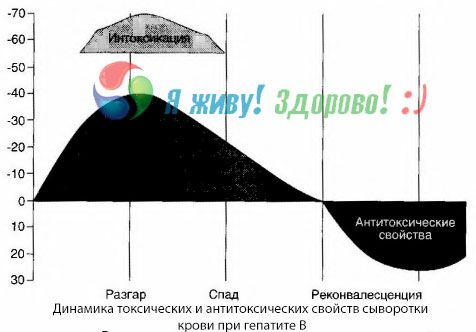
De methode van bloedkweken heeft aangetoond dat bij hepatitis B toxines zich constant in het bloed ophopen, die vrijkomen uit het beschadigde, rottende leverweefsel. De concentratie van deze toxines is evenredig met de ernst van de ziekte; ze zijn eiwitachtig.
Tijdens de herstelperiode worden er antistoffen tegen dit toxine in het bloed aangetroffen. Bij een levercoma stijgt de concentratie van het toxine in het bloed echter sterk, zodat er geen antistoffen in het bloed worden aangetroffen.
Pathomorfologie van hepatitis B
Op basis van de aard van de morfologische veranderingen worden drie vormen van acute hepatitis B onderscheiden:
- cyclische vorm,
- massale levernecrose;
- cholestatische pericholangiolytische hepatitis.
Bij de cyclische vorm van hepatitis B zijn de dystrofische, inflammatoire en proliferatieve veranderingen meer uitgesproken in het centrum van de lobben, terwijl ze bij hepatitis A gelokaliseerd zijn langs de periferie van de lobben en zich naar het centrum verspreiden. Deze verschillen worden verklaard door verschillende routes waarlangs het virus het leverparenchym binnendringt. Het hepatitis A-virus dringt de lever binnen via de poortader en verspreidt zich naar het centrum van de lobben. Het hepatitis B-virus dringt door via de leverslagader en haarvaten die alle lobben gelijkmatig van bloed voorzien, tot aan het centrum.
De mate van beschadiging van het leverparenchym komt in de meeste gevallen overeen met de ernst van de klinische manifestaties van de ziekte. Bij milde vormen wordt meestal focale necrose van hepatocyten waargenomen, en bij matige en ernstige vormen zonale necrose (met een neiging tot samensmelting en brugachtige necrose bij ernstige vormen van de ziekte).
De grootste morfologische veranderingen in het parenchym worden waargenomen op het hoogtepunt van de klinische manifestaties, die meestal samenvallen met het eerste decennium van de ziekte. Tijdens het tweede en vooral derde decennium intensiveren de regeneratieprocessen. Tegen deze tijd verdwijnen de necrobiotische veranderingen bijna volledig en beginnen cellulaire infiltratieprocessen de overhand te krijgen, met een langzaam daaropvolgend herstel van de structuur van de hepatocellulaire platen. Volledig herstel van de structuur en functie van het leverparenchym vindt echter pas 3-6 maanden na het begin van de ziekte plaats, en niet bij alle patiënten.
Het algemene karakter van de infectie bij hepatitis B wordt bevestigd door de detectie van HBsAg, niet alleen in hepatocyten, maar ook in de nieren, longen, milt, pancreas, beenmergcellen, enz.
Cholestatische (pericholangiolytische) hepatitis is een bijzondere vorm van de ziekte, waarbij de grootste morfologische veranderingen worden aangetroffen in de intrahepatische galwegen, met een beeld van cholangiolitis en pericholangiolitis. Bij de cholestatische vorm treedt cholestase op met verwijding van de galcapillairen met galstagnatie daarin, met proliferatie van cholangiolen en cellulaire infiltraten eromheen. Levercellen worden bij deze vorm van hepatitis in geringe mate aangetast. Klinisch wordt de ziekte gekenmerkt door een langdurig beloop met aanhoudende geelzucht. Het is aangetoond dat de oorzaak van dit bijzondere beloop de overheersende invloed van het virus op de wanden van de cholangiolen is, met een insignificant effect op hepatocyten.

