Medisch expert van het artikel
Nieuwe publicaties
Osteoblastoclastoom
Laatst beoordeeld: 07.06.2024

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
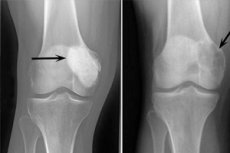
Osteoblastoclastoom is een tumorproces dat goedaardig of kwaadaardig kan zijn en verschillende skeletbotten beschadigt. In eerste instantie werd de pathologie gigantocellulaire tumor genoemd (sinds 1912), 10 jaar later stelde Dr. Stewart de naam Osteoclastoma voor. En pas in 1924 introduceerde professor Rusakov de verfijnde term "osteoblastoclastoom", die vollediger overeenkwam met de cellulaire samenstelling van het neoplasma.
Tegenwoordig wordt osteoblastoclastoom beschouwd als een echt neoplasma, een zachte weefseltumor met een uitgebreid vasculair netwerk. De enige juiste behandelingsoptie is het verwijderen van de tumor in gezonde weefsels, soms gelijktijdig met bottransplantatie. [1] ]
Epidemiologie
De incidentie van bottumoren wereldwijd varieert van 0,5 tot 2%. Volgens statistieken van de Verenigde Staten zijn osteosarcoom (ongeveer 34%van de gevallen), Chondrosarcoma (27%) en de tumor van Ewing (18-19%) de meest voorkomende. Chordomas, fibrosarcomen, fibrosarcomen, histiocytomen, gigantische celtumoren en angiosarcomen komen minder vaak voor.
De incidentie is sterk gecorreleerd met de leeftijd. Aldus wordt de eerste golf van tumorgroei gedetecteerd in de adolescentie (ongeveer 16 jaar oud) en de tweede golf op middelbare leeftijd.
Osteoblastoclastoom is een relatief veel voorkomende tumor. Het komt voor in ongeveer 2-30% van alle bottenneoplasmata. Vrouwen worden vaker getroffen, maar mannen kunnen ook worden getroffen, voornamelijk tussen de 18 en 40 jaar. Kinderen jonger dan 12 jaar worden zelden getroffen, maar zelfs in deze leeftijdsperiode is de incidentie niet uitgesloten. Er zijn beschrijvingen van familiale en erfelijke gevallen van osteoblastoclastoom.
Meestal (ongeveer 75%) wordt de tumor aangetroffen in lange buisvormige botten, veel minder vlakke en kleine botten worden aangetast.
In lange buisvormige botten wordt de epimetafyse voornamelijk beïnvloed en in de kindertijd wordt de metafyse beïnvloed. Het neoplasma ontspruit niet in het gebied van epiphysenale en gewrichtskraakbeen. Zeer zelden wordt het probleem gevonden in de diafyse (minder dan 0,5% van de gevallen).
Opgemerkt wordt dat met de ontwikkeling van de geneeskunde de incidentie van osteoblastoclastoom stabiel blijft, maar de sterftecijfers zijn aanzienlijk verlaagd. De belangrijkste en meest waarschijnlijke oorzaak van pathologie wordt beschouwd als de impact van ioniserende straling. De risico's worden dus verhoogd bij mensen die hoge doses radiotherapie hebben ontvangen, evenals bij patiënten die zijn geïnjecteerd met radio-isotopen (voor diagnose of therapeutische doeleinden). Andere veel voorkomende etiologische factoren zijn ongunstige ecologie en erfelijkheid. [2]
Oorzaken Osteoblastoclastomen
Osteoblastoclastoom is een focus van pathologisch veranderde cellen die in bijna elk deel van het skelet kunnen verschijnen. Ondanks de afwijkingen van de structuur blijven pathologische cellen zich verdelen, zoals in gezonde weefsels. Hun structuur verschilt grotendeels van de norm, die de vervanging van de eigenschappen van het direct aangetaste bot en de typische functie ervan met zich meebrengt. Pathologisch veranderde kwaadaardige cellen verwerven een neiging tot ongecontroleerde, vaak snelle vermenigvuldiging, waardoor het tumorvolume toeneemt. Voorheen kan normaal botweefsel worden verplaatst door de structuren van het neoplasma, en individuele pathologische cellen kunnen worden gescheiden en getransporteerd met bloed of lymfe naar andere, verre anatomische zones. Op deze manier worden metastasen gevormd.
Het is bekend dat de bron van kwaadaardig osteoblastoclastoom elk kwaadaardig neoplasma kan zijn dat zich in elk deel van het lichaam bevindt (inclusief tumoren van interne organen). De manier van verspreiding van het proces is metastase. Maar de meeste osteoblastoclastomen (zowel goedaardig als kwaadaardig) zijn primaire neoplasmata die voorop en op dezelfde plaats verschijnen en ontwikkelen.
Over het algemeen zijn osteoblastoclastomen multifactoriële tumoren waarvan de exacte oorzaken op dit moment niet zijn vastgesteld. Voorwaarden voor het voorkomen van neoplasma omvatten dingen als:
- Een immunodeficiëntietoestand;
- Aangeboren weefselveranderingen;
- Mutagene omgevingsinvloeden;
- Hormonale veranderingen;
- Gelijktijdige pathologieën en verwondingen (trauma is vaak aanwezig in de anamnesis).
Risicofactoren
Er is een gebrek aan precieze gegevens over de oorzaken van osteoblastoclastoomvorming. Experts suggereren echter de betrokkenheid van een aantal factoren die verband houden met een verhoogd risico op bot-oncopathologieën:
- Erfelijkheid. In veel gevallen wordt de neiging tot tumorprocessen genetisch bepaald. In het bijzonder kan dit het geval zijn met het Leigh Fraumeni-syndroom, dat vatbaar is voor de ontwikkeling van verschillende neoplasmata, waaronder kankerachtige tumoren en sarcomen.
- De ziekte van Paget. De ziekte kan een of meer botten beïnvloeden en behoort tot pre-tumor pathologieën. Bij patiënten met deze aandoening worden de botten dikker en worden ze tegelijkertijd bros, wat resulteert in frequente pathologische fracturen. Osteosarcomen komen voor in ongeveer 8% van de gevallen van de ziekte van een ernstige Paget.
- Meerdere benige overgroei, exostoses.
- Meerdere osteochondromen (inclusief erfelijk).
- Meerdere enchondromen (risico is klein maar nog steeds aanwezig).
- Blootstelling aan straling (inclusief intense straling die wordt gebruikt om andere tumorprocessen en de effecten van radioactief radium en strontium te behandelen).
Een speciale risicocategorie omvat stralingsbehandeling in de kindertijd en jonge leeftijd, die doses van meer dan 60 grijs ontvangen.
Experts vestigen de aandacht op het feit dat niet-ioniserende stralen - in het bijzonder magnetron- en elektromagnetische straling, die worden gevormd uit hoogspanningsleidingen, mobiele telefoons en huishoudelijke apparaten - geen risico's van osteoblastoclastoom met zich meebrengen.
Pathogenese
De pathogenetische kenmerken van het uiterlijk en de ontwikkeling van osteoblastoclastoom worden niet volledig begrepen, wat te wijten is aan de complexiteit van de pathologie. De basisoorzaak van tumorvorming is een mislukking in celdifferentiatie als gevolg van de onjuist werking van het immuunsysteem. Dit geeft aanleiding tot de groei van een tumor bestaande uit "fout", ongedifferentieerde cellen, die de eigenschappen van het neoplasma bepalen en structureel lijken op onrijpe cellen. Als de cellulaire structuur bijna normaal is, maar dat niet is, wordt gezegd dat het een goedaardig osteoblastoclastoom is. Met uitgesproken veranderingen in de structuur van cellen wordt de tumor toegeschreven aan kwaadaardige processen. Voor een dergelijk neoplasma zijn een verandering in de antigene cellulaire vouw, ongecontroleerde groei en celdeling typisch. Samen met het verlies van specificiteit van de cellulaire structuur lijdt de functionaliteit ook. Onder andere verschilt kwaadaardig osteoblastoclastoom van goedaardige osteoblastoclastoom door het proces van invasie in nabijgelegen gezonde weefsels. In goedaardig bot neoplasma is er geen ontspruiten in gezonde structuren, er is geen neiging tot snelle groei en verspreid over het lichaam, er is geen neiging tot willekeurige zelfvernietiging en intoxicatie door producten van tumorontleding.
De botstructuur wordt in alle gevallen vernietigd, ongeacht de goedheid van de pathologie. Als gevolg hiervan wordt het getroffen botsegment kwetsbaar, bros. Vaak is de reden om zich tot artsen te wenden een pathologische breuk die zelfs onder minimale belasting optreedt.
Het is belangrijk op te merken: de goedheid van het proces is altijd een voorwaardelijke toestand, omdat er risico's van malignisatie zijn en de goedaardige focus wordt getransformeerd, kwaadaardige osteoblastoclastoom treedt op.
Symptomen Osteoblastoclastomen
Het klinische beeld in osteoblastoclastoom hangt voornamelijk af van de lokalisatie en het stadium van het pathologische proces. In de regel wordt de tumor gekenmerkt door de volgende kenmerken:
- Het neoplasma is solitair;
- Beïnvloedt voornamelijk de buisvormige botten van de onderste of bovenste ledematen;
- Wordt minder vaak aangetroffen in platte botten;
- Er is een zeurende pijn in het getroffen segment;
- Het huid en het vasculaire patroon over de pathologische focus neemt toe;
- Het zieke ledemaat is vervormd (gelokaliseerde volumeverhoging);
- Het werk van het gewricht dat het dichtst bij het osteoblastoclastoom of het ledemaat als geheel is gestoord;
- Palpatorisch bepaalde verdichte focus met een karakteristieke "perkament crunch".
Over het algemeen kunnen symptomen worden onderverdeeld in lokale en algemene symptomen. Lokale symptomen worden visueel gedetecteerd - in het bijzonder ziet u de aanwezigheid van kromming of uitpuilen van het botfragment. Aandacht wordt ook getrokken door de verandering in de huid over de pathologische focus: een vasculair patroon wordt duidelijk gemanifesteerd, de weefsels worden gezwollen of afgeplat. De tumor kan worden gepalpeerd - vaak is het pijnloos, maar heeft een karakteristieke structuur. Kwaadaardige tumoren zijn typisch klonterig en onregelmatig in configuratie.
Het aangrenzende gewricht kan beperkt zijn in beweging, aanhoudend pijnlijk. Vanwege de compressie van vaten en zenuwstammen wordt de gevoeligheid vaak aangetast en verschijnt aanhoudende zwelling. Het lymfestelsel reageert ook: nabijgelegen lymfeklieren worden vergroot.
Algemene symptomatologie is typischer voor kwaadaardige osteoblastoclastomen en is te wijten aan de processen van intoxicatie van het lichaam. Patiënten kunnen hebben:
- Koorts, febriele aandoeningen;
- Onuitputtelijkheid;
- Constante zwakte;
- Slaperigheid of slapeloosheid, eetluststoornissen;
- Nachtelijk overmatig zweten;
- Instorten.
Er is ook een klein percentage osteoblastoclastomen, die meestal klein zijn en niet klinisch duidelijk zijn. Ze worden om andere redenen een incidentele bevinding tijdens radiologische of beeldvormende studies.
Eerste tekenen van osteoblastoclastoom ossificatie
- Versnellen de groei van het neoplasma.
- Verhoogd pijnsyndroom.
- Uitbreiding van de destructieve focus in diameter of transformatie van de cellulaire trabeculaire vorm in een lytische vorm.
- Desintegratie van de corticale laag over een relatief lang gebied.
- Verlies van duidelijkheid van configuraties van de destructieve focus.
- Desintegratie van de sluitingsplaat die vroeger het medullaire kanaal blokkeert.
- Periostale reactie.
Osteoblastoclastoma maligniteit is gebaseerd op klinische en radiologische indicatoren en wordt noodzakelijkerwijs bevestigd door morfologische diagnose van tumorweefsels.
Naast osloplasticisatie van een aanvankelijk goedaardig neoplasma, is er ook een primair kwaadaardig osteoblastoclastoom. In feite is een dergelijke tumor een soort sarcoom van osteogene etiologie.
De locatie van kwaadaardig osteoblastoclastoom is hetzelfde als in het goedaardige proces. Radiografie onthult een destructieve focus in het botweefsel zonder duidelijke contouren. De vernietiging van de corticale laag wordt uitgebreid, vaak ontspruiten in zachte weefselstructuren wordt waargenomen.
Tekenen om kwaadaardig osteoblastoclastoom te onderscheiden van de osteogene vorm van osteoclastische sarcoom:
- De overwegend oudere leeftijd van de patiënten;
- Minder levendige symptomatologie;
- Een gunstiger langdurige prognose.
Osteoblastoclastoom bij kinderen
Osteoblastoclastoom in de kindertijd is zeldzaam: er zijn slechts twee of drie gevallen per miljoen kinderen. Opgemerkt moet worden dat bij alle pediatrische patiënten de ouder dan 10-15 jaar overheersen.
Wetenschappers kunnen niet de exacte oorzaak van osteoblastoclastoom bij kinderen noemen. Vermoedelijk wordt de pathologie geassocieerd met intensieve groei van het lichaam van het kind, evenals met een genetische factor.
Er zijn ook indicaties van mogelijke oorzaken als radioactieve blootstelling (met name radiotherapie), chemotherapie (cytostatica nemen). Veel chemotherapie-geneesmiddelen kunnen het genetische materiaal van botcellen vernietigen, wat leidt tot de ontwikkeling van tumorigenese.
Bovendien is het risico op osteoblastoclastoom hoger bij kinderen met bepaalde aangeboren aandoeningen, zoals bilateraal retinoblastoom of Li-Fraumeni-syndroom. Er bestaat ook een causaal link met de ziekte van Paget.
Het is ook bekend dat in de overgrote meerderheid van de kinderen (ongeveer 90%) artsen geen van de hierboven genoemde risicofactoren kunnen detecteren.
Het is moeilijk om het verloop van osteoblastoclastoom in de kindertijd te voorspellen, omdat het afhankelijk is van de kenmerken van een bepaalde tumor, de lokalisatie ervan, de mate van verspreiding op het moment van diagnose, de tijdigheid van behandeling en volledigheid van verwijdering van het neoplasma.
De kwaliteit van de behandeling met osteoblastoclastoom heeft de afgelopen 2-3 decennia grote vooruitgang geboekt. Het therapeutische protocol is gecombineerd en het genezingspercentage is toegenomen tot meer dan 70-80%. Een gunstig resultaat kan worden gezegd als het tumorproces radicaal chirurgisch wordt verwijderd en het effect wordt geconsolideerd met een voldoende chemotherapie. Kinderen met goedaardige osteoblastoclastoom hebben de beste kans op herstel.
Wanneer specifieke cijfers van genezende patiënten worden aangekondigd, zien we alleen algemene cijfers: geen statistieken kunnen de kansen voor een bepaald kind nauwkeurig voorspellen en bepalen. De term "herstel" wordt voornamelijk opgevat als "afwezigheid van tumorproces in het lichaam", omdat moderne therapeutische benaderingen in staat zijn om de langdurige afwezigheid van herhaling te garanderen. Men moet echter de mogelijkheid van ongewenste bijwerkingen en late complicaties echter niet vergeten. Daarom moet elke behandeling, ongeacht de complexiteit ervan, stromen in hoogwaardige revalidatiemaatregelen. Bovendien hebben kinderen nog lang nog lang orthopedische zorg nodig.
Vormen
De classificatie van neoplasmata van botweefsel is vrij breed. Aandacht wordt voornamelijk besteed aan variaties in de cellulaire structuur, morfologische kenmerken van het tumorproces. Tumoren zijn dus verdeeld in twee categorieën:
- Osteogeen (gevormd op basis van botcellen);
- Neosteogeen (gevormd in bot onder invloed van andere celtypen - bijvoorbeeld vasculaire of bindweefselstructuren).
Osteoblastoclastoom van bot is voornamelijk een goedaardig neoplasma. Desondanks heeft het echter vaak een agressieve groei, draagt het bij aan de vernietiging en dunner worden van botweefsels, wat chirurgische interventie verplicht maakt. Tegelijkertijd kan gigantische cel osteoblastoclastoom ook kwaadaardig zijn.
Afhankelijk van klinische en radiologische parameters en morfologisch beeld, worden drie basisvormen van osteoblastoclastomen onderscheiden:
- De cellulaire vorm wordt voornamelijk gevonden bij ouderen, deze wordt gekenmerkt door langzame ontwikkeling. Diagnose onthult een verdikte, klonterige zwelling, zonder de mogelijkheid van klinische afbakening van de tumorfocus uit gezonde botzones.
- Cystische vorm manifesteert zich allereerst met pijn. Palpatorisch wordt het symptoom van "perkament crunch" bepaald. Visueel wordt een benige tumor van soepel convexe, koepelvormige configuratie opgemerkt.
- De lytische vorm wordt beschouwd als een zeldzame variant van pathologie, deze wordt voornamelijk gedetecteerd in de adolescentie. Het tumorproces ontwikkelt zich snel genoeg, de patiënt begint last te krijgen van pijn, ook bij palpatie.
Een gigantische celtumor kan zich vormen op bijna elk bot van het skelet, hoewel de buisvormige botten van de ledematen, ribben en wervelkolom enigszins vaker worden beïnvloed. Osteoblastoclastoom van de onderkaak treedt twee keer zo vaak voor als op de bovenkaak. Palpatorisch wordt een dicht neoplasma met verzachtte zones opgemerkt. De meest voorkomende klachten van patiënten: de aanwezigheid van een uitstulping die bloedt en ongemak creëert bij het kauwen van voedsel. Naarmate het probleem vordert, wordt het aangevuld met een verminderde functie van het temporomandibulaire gewricht. Onder de buisvormige botten beïnvloedt de tumor vaker het dijbeen en het scheenbeen. Osteoblastoclastoom van het dijbeen wordt voornamelijk gevonden bij mensen van middelbare leeftijd. De ziekte gaat gepaard met een verminderde functie van het overeenkomstige gewricht, kreupelheid treedt op en de huid over het neoplasma is bedekt met een uitgesproken vasculair patroon.
Naast de bovenstaande classificatie zijn er centrale en perifere vormen van pathologie, hoewel er geen morfologische verschillen tussen hen zijn. Perifeer osteoblastoclastoom heeft een gingivale lokalisatie en de centrale vorm ontwikkelt zich in het bot en onderscheidt zich door de aanwezigheid van meerdere bloedingen erin (daarom is de tweede naam van het centrale osteoblastoclastoom een bruine tumor). Het uiterlijk van een bruine kleur is te wijten aan de afzetting van erytrocyten, die uiteenvallen met de vorming van hemosiderine.
Kwaadaardige botneoplasmata doorlopen de volgende fasen in hun ontwikkeling:
- Een T1-foci van 3-5 cm meten bevindt zich in het bot en één musculofasciaal segment.
- De T2-foci strekken zich niet meer dan 10 cm uit in het kader van het bot, maar strekken zich niet verder dan één fasciaal geval uit.
- De T3-foci verlaten de grenzen van één musculofasciale zaak en ontspruit in een nabijgelegen.
- De T4-foci ontspruit uit de huid of neurovasculaire stammen.
Op dezelfde manier zijn de mate van lymfeklierbetrokkenheid en de verspreiding van metastasen gecategoriseerd.
Complicaties en gevolgen
Een van de complicaties van osteoblastoclastoom is een toename van de activiteit van het neoplasma, die vooral vaak voorkomt tegen de achtergrond van een lange stille periode. In sommige dergelijke gevallen hebben we het over kwaadaardige degeneratie van het tumorproces, of het ontspruiten ervan in gevoelige nabijgelegen anatomische structuren:
- Verspreid naar de zenuwstam veroorzaakt het optreden van het neuropathische pijnsyndroom vanwege het effect op de zenuw van de grote kaliber. Dergelijke pijn wordt praktisch niet geëlimineerd na het nemen van conventionele analgetica, zodat het de patiënt letterlijk uitputt.
- Verspreid naar de bloedvaten kan worden gecompliceerd door plotselinge massieve bloedingen en hematoomvorming.
Complicaties worden niet uitgesloten, die gepaard gaan met een schending van de functie van de nabijgelegen articulaties: de groei van osteoblastoclastoom in een dergelijke situatie blokkeert de adequate werking van het musculoskeletale mechanisme, dat leidt tot een beperkt bewegingsbereik en het uiterlijk van pijnsyndroom.
De meest voorkomende complicaties van osteoblastoclastoom worden beschouwd als pathologische fracturen in het getroffen gebied. Het probleem treedt zelfs op met een kleine traumatische impact, omdat het botweefsel extreem kwetsbaar en onstabiel wordt.
Bovendien praten specialisten ook over specifieke algemene en lokale bijwerkingen die kenmerkend zijn voor kwaadaardig osteoblastoclastoom:
- De vorming van verre en bijna metastasen;
- Intoxicatie van het lichaam met vervalproducten.
Als metastasen enige tijd na de initiële diagnostische maatregelen worden gedetecteerd, duidt dit op de ineffectiviteit van de voortdurende behandeling en progressie van het neoplasma.
Een afzonderlijke lijn complicaties is de opkomst van nieuwe tumor of algemene pathologie als gevolg van chemotherapie of bestraling van de osteoblastoclastoma-botfocus.
Diagnostics Osteoblastoclastomen
Diagnostische methoden die worden gebruikt om osteoblastoclastoom te detecteren, zijn onder meer:
- Klinisch, dat extern onderzoek en palpatie van het pathologisch veranderde gebied omvat;
- Röntgenfoto's (anteroposterior en laterale radiografie, indien aangegeven - gerichte en schuine radiografie);
- Tomografische (met behulp van geautomatiseerde of magnetische resonantie-beeldvorming);
- Radio-isotoop;
- Morfologisch, dat histologische, histochemische, cytologische analyse van biomateriaal verkregen tijdens lek of trepanobiopsie omvat;
- Laboratorium.
De arts bestudeert zorgvuldig de geschiedenis van de ziekte, bepaalt de eerste tekenen, specificeert de locatie en het type pijnsyndroom, de kenmerken ervan, houdt rekening met de resultaten van eerdere onderzoeken en behandelingsprocedures, beoordeelt de dynamiek van de algemene toestand van de patiënt. Als de pathologie van lange buisvormige botten wordt vermoed, besteedt de specialist aandacht aan de aanwezigheid van zwelling, motorische beperking in de nauwere articulatie, evenals de aanwezigheid van neurologische symptomen, spierzwakte en hypotrofie. Het is belangrijk om interne organen zorgvuldig te onderzoeken op mogelijke verspreiding van metastasen.
Alle patiënten doen algemene bloed- en urinetests met bepaling van eiwit- en eiwitfracties, fosfor en calcium, siaalzuren. Het is ook noodzakelijk om de enzymatische activiteit van fosfatasen te bepalen, een definitieve test uit te voeren, de index van C-reactief eiwit te bestuderen. Als het nodig is om osteoblastoclastoom van Myloma te differentiëren, slaagt de patiënt door voor een urinetest voor de aanwezigheid van pathologisch eiwit van Bence-Jones.
Radiologische diagnose is fundamenteel voor de diagnose van osteoblastoclastoom. Verplichte benoemde beoordeling en gerichte röntgenfoto, hoogwaardige tomografie, waardoor de locatie, het type pathologische focus, de verspreiding van andere weefsels en organen mogelijk is. Dankzij CT is het mogelijk om de toestand van zachte weefsel en de dunste botstructuren in het benodigde vlak te verduidelijken om diepe foci van pathologische vernietiging te identificeren, om hun parameters binnen de botlimieten te beschrijven, om de mate van schade aan de omliggende weefsels te bepalen.
Tegelijkertijd wordt MRI beschouwd als de meest informatieve diagnostische procedure, die een aantal voordelen heeft ten opzichte van zowel radiografie als CT. Met de methode kunt u zelfs de dunste weefsellagen onderzoeken, een beeld vormen van pathologische chag met behulp van een ruimtelijk driedimensionaal beeld.
Verplichte instrumentale diagnostiek wordt weergegeven door morfologische studies. Biomateriaal wordt geëvalueerd, dat wordt verkregen tijdens aspiratie en trepanobiopsie, of tijdens resectie van botsegmenten samen met het neoplasma. Lekbiopsie wordt uitgevoerd met behulp van speciale naalden en radiologische controle.
De volgende röntgenborden worden beschouwd als typisch voor osteoblastoclastoom:
- Porositeitsbeperking;
- Homogeniteit van botlysis in het type dunne trabeculisatie;
- De aanwezigheid van pseudocystische lucencies die de structuur hebben van bijzondere "zeepbellen".
Dit radiologische beeld gaat gepaard met de afwezigheid van primaire of secundaire reactieve osteoformatieve periostosis. Dunner worden en atrofie van de corticale laag worden gedetecteerd.
Kwaadaardig type osteoblastoclastoom als gevolg van intensieve vasculaire kiemen brengt een toename van veneuze stasis in. Vasculaire veranderingen hebben het uiterlijk van een neoplasma met overvloedige vascularisatie.
Differentiële diagnose
Het is soms heel moeilijk om osteoblastoclastoom te identificeren. Er ontstaan problemen tijdens differentiële diagnose van de ziekte met osteogene sarcoom- en botcysten bij patiënten van verschillende leeftijden. Volgens de statistieken werd in meer dan 3% van de gevallen osteoblastoclastoom aangezien voor osteogene sarcoom en in bijna 14% van de gevallen - voor botcyste.
De tabel vat de belangrijkste tekenen van deze pathologieën samen:
Indicatoren |
Osteoblastoclastoom |
Osteogene osteoplastische sarcoom |
Botcyste |
Meest voorkomende leeftijd van incidentie |
20 tot 30 jaar oud |
20 tot 26 jaar oud |
Kinderen jonger dan 14 jaar |
Locatie |
Epimetaphyseal-regio |
Epimetaphyseal-regio |
Metadiaphysgebied |
Botherconfiguratie |
Ernstige asymmetrische bobbel. |
Kleine transversale expansie |
Een spindelvormige bobbel. |
Configuratie van de destructieve focus |
De contouren zijn duidelijk |
De contouren zijn wazig, er is geen duidelijkheid |
De contouren zijn duidelijk |
De toestand van het wervelkanaal |
Bedekt met een sluitplaat |
Open aan de grens met het neoplasma |
Geen verandering. |
Conditie van de corticale laag |
Dun, vezelachtig, discontinu. |
Dunner, geruïneerd |
Dun, plat |
Sclerose fenomeen |
Atypisch |
Cadeau |
Atypisch |
Periostale reactie |
Afwezig |
Aanwezig op een "periostale vizier" soort manier |
Afwezig |
De toestand van de epifyse |
De lamina is dun, golvend. |
In de beginfase blijft een deel van de epiphysis intact |
Geen verandering. |
Nabijgelegen botgedeelte |
Geen verandering. |
Tekenen van osteoporose |
Geen verandering. |
Verplichte aandacht vereist dergelijke indicatoren als de leeftijd van de patiënt, de duur van de pathologie, de locatie van de getroffen focus, andere anamnestische informatie die in de tabel wordt aangegeven.
De volgende diagnostische fouten komen het meest voor, wanneer osteoblastoclastoom wordt verward met dergelijke pathologische processen:
- Aneurysmale cyste (gelokaliseerd in de diafyse of metafyse van lange buisvormige botten);
- Monoaxiaal type vezelachtige osteodysplasie (voornamelijk gemanifesteerd in de kindertijd, vergezeld van botkromming zonder botballonvaren);
- Hyperparathyroid osteodystrofie (geen duidelijke afbakening van de focus uit het gezonde botgebied, geen duidelijke bottenbult);
- Solitaire kankerachtige botmetastase (gekenmerkt door destructieve foci met gebogen "opgegeten" contouren).
Het is belangrijk om in gedachten te houden dat goedaardige osteoblastoclastoom altijd kan transformeren en kwaadaardig kan worden. De oorzaken van maligniteit zijn nog niet precies bepaald, maar wetenschappers geloven dat trauma en hormonale veranderingen (bijvoorbeeld tijdens de zwangerschap) eraan bijdragen. Volgens sommige observaties is ook malignisatie opgetreden met herhaalde reeks externe stralingsbehandelingen.
Symptomen van ossificatie:
- Het neoplasma begint snel te groeien;
- De pijn wordt erger;
- De grootte van de destructieve focus neemt toe en de cellulaire trabeculaire fase-overgangen naar de lytische fase;
- De corticale laag is afgebroken;
- De contouren van de destructieve focus worden onduidelijk;
- De vergrendelingsplaat stort in;
- Er is een periostale reactie.
In het proces van differentiatie van primair kwaadaardig neoplasma (osteogene osteoclastische sarcoom) en kwaadaardig osteoblastoclastoom, wordt speciale aandacht besteed aan de duur van de pathologie, beoordeling van het radiologische beeld in dynamiek. Op het röntgenbeeld van het primaire kwaadaardige neoplasma is er geen botuitsteeksel typisch voor osteoblastoclastoom, er zijn geen botbruggen, sclerosed gebied met onduidelijke contouren kunnen worden gedetecteerd. In de malignisatie is er echter vaak een klein deel van de sluitplaat, die vroeger diende als barrière voor het gezonde bottensegment.
Met wie kun je contact opnemen?
Behandeling Osteoblastoclastomen
De enige juiste behandeling voor patiënten met osteoblastoclastoom is een operatie. De meest zachte interventie vindt plaats in de beginfase van de ontwikkeling van tumorproces en vertegenwoordigt excisie van de getroffen weefsels met verdere vulling van de holte met een transplantaat. Het transplantaat is afkomstig van een ander gezond bot van de patiënt. Een dergelijke interventie is het meest gunstig en minder traumatisch, maar in sommige gevallen is het ook minder radicaal. Excisie van het aangetaste botfragment samen met het neoplasma wordt beschouwd als een betrouwbaardere methode, die de kans op tumor-hergroei tot een minimum vermindert.
Als het een verwaarloosd osteoblastoclastoom van grote omvang is, vooral vatbaar voor malignisatie of al kwaadaardig, wordt gedeeltelijke of volledige amputatie van de ledemaat vaak overwogen.
Over het algemeen wordt de tactiek van chirurgische behandeling voor osteoblastoclastoom geselecteerd, afhankelijk van de locatie, verspreiding en agressiviteit van de pathologische focus.
Als de tumor de lange buisvormige botten beïnvloedt, wordt het aanbevolen om aandacht te schenken aan dit soort chirurgische interventies:
- Randresectie met alloplastiek of autoplastie voor goedaardig, vertraagd proces, foci met een cellulaire structuur en in de periferie van de epimetafyse. Fixatie met metalen schroeven.
- Wanneer cellulair osteoblastoclastoom zich verspreidt naar het midden van de botdiameter, worden tweederde van de condyle, gedeeltelijk van de diafyse en het gewrichtsoppervlak geresecteerd. Het defect is gevuld met gewrichtskraakbeen allograft. Het is stevig opgelost met tie-bouten en schroeven.
- In het geval van epimetafyse verval langs de gehele lengte of pathologische breuk, worden tactieken zoals segmentale resectie met gewrichts excisie en het vullen van het defect met allograft gebruikt. Het is bevestigd met een gecementeerde staaf.
- In het geval van pathologische breuk en malignisatie van osteoblastoclastoom in het proximale dijbeengebied, wordt de totale heupartroplastiek uitgevoerd.
- In het geval van resectie van de uiteinden in de gezamenlijke zone van de knie, wordt de techniek van allopolysubstance-transplantatie met fixatie gebruikt. De totale endoprosthese met een uitgebreide titaniumstam heeft vaak de voorkeur om de latere bestralingsbehandeling te garanderen.
- Als de pathologische focus zich aan het distale uiteinde van het scheenbeen bevindt, wordt resectie met bot-plastic enkelartrodese uitgevoerd. Als het talusbot wordt beïnvloed, wordt het uitgeroeid met extensieartrodese.
- In cervicale wervelkolomlaesies wordt een voorste toegang tot de C1En C2Vertebrae uitgevoerd. Een anterolaterale toegang heeft de voorkeur. Op de Th1-th2Niveau wordt een voorste toegang met schuine sternotomie tot de derde intercostale ruimte gebruikt (vaten worden zorgvuldig naar beneden verschoven). Als de tumor de lichamen van 3-5 thoracale wervels beïnvloedt, wordt een anterolaterale toegang met resectie van de derde rib uitgevoerd. Het schouderblad wordt achteruit verschoven zonder het spierstelsel af te snijden. Als het osteoblastoclastoom wordt gevonden in het thoracolumbale gebied tussen Th11En L2, is de werking van keuze de juiste thoracofrenolumbotomie. Toegang tot het voorste deel van de bovenste 3 wervels van het heiligbeen is moeilijker. Een anterolaterale retroperitoneale rechtszijdige toegang met zorgvuldige drainage van de vasculaire stammen en ureter wordt aanbevolen.
- Als de wervellichamen ernstig worden vernietigd, of de pathologie zich heeft verspreid naar het booggebied in de thoracale en lumbosacrale wervelkolom, wordt in dit geval de fixatie van de translaminar van de wervelkolom van de wervelkolom uitgevoerd, waarna de vernietigde wervels worden verwijderd met verdere autoplastie.
- Als een goedaardige vorm van osteoblastoclastoom wordt gedetecteerd in het wenkbrauw en het heupbot, wordt het pathologisch veranderde segment in gezonde weefsels verwijderd, zonder bottransplantatie. Als de vloer en het dak van het acetabulum worden beïnvloed, wordt resectie uitgevoerd met verder bottransplantatie om het defect te vervangen, met fixatie met spongiose-bevestigingsmiddelen.
- Als het iliacale, boezem- of heupbot wordt beïnvloed, worden alloplastiek met een structurele allograft, transplantatie osteosynthese, op cement gebaseerde plastic insertie en herpositionering van de prothetische kop in een kunstmatige holte uitgevoerd.
- If the sacrum and L2AreAffected, a two-stage intervention is performed, including posterior access resection of the pathologically altered lower sacral fragment (up to S2), transpedicular fixation and removal of the neoplasm from the anterior side by retroperitoneal method with bone grafting.
In elke specifieke situatie bepaalt de arts de meest geschikte methode voor chirurgische interventie, inclusief het overwegen van de mogelijkheid om de nieuwste technologie toe te passen om de resultaten van de behandeling te verbeteren en de normale levenskwaliteit van de patiënt te waarborgen.
Het voorkomen
Er is geen specifieke preventie van osteoblastoclastoom. Allereerst is dit te wijten aan de onvoldoende studie van de oorzaken van de ontwikkeling van dergelijke tumoren. Veel experts benadrukken de preventie van trauma tot het botsysteem bij de belangrijkste preventieve punten. Er zijn echter geen bewijs van de directe invloed van trauma op de vorming van botneoplasmata, en trauma vestigt in veel gevallen alleen de aandacht op het bestaande tumorproces en heeft geen duidelijke betekenis in de oorsprong van de pathologische focus, maar tegelijkertijd kan het bijdragen aan de groei ervan.
Het moet niet worden vergeten dat osteoblastoclastoom zich vaak vormt in botten die eerder zijn blootgesteld aan ioniserende straling - bijvoorbeeld met het oog op therapie van andere tumorprocessen. Radio-geïnduceerde neoplasmata treden meestal niet eerder dan 3 jaar na de blootstelling aan straling op.
Niet-specifieke preventieve maatregelen zijn onder meer:
- Eliminatie van slechte gewoonten;
- Een gezonde levensstijl leiden;
- Kwaliteit en duurzame voeding;
- Matige regelmatige fysieke activiteit;
- Preventie van verwondingen, tijdige behandeling van pathologische processen in het lichaam, stabilisatie van immuniteit.
Prognose
Pathologische fracturen komen vaak voor in het getroffen gebied van botweefsel. In dit geval hebben goedaardige neoplasmata, op voorwaarde dat een radicale behandelingsmethode wordt gebruikt, een gunstige prognose hebben, hoewel de mogelijkheid van recidieven en maligniteit van de pathologische focus niet is uitgesloten. Een ongunstige uitkomst van goedaardige osteoblastoclastoom is niet uitgesloten als de focus wordt gekenmerkt door actieve groei en uitgesproken botvernietiging. Een dergelijke tumor kan snel een heel botsegment vernietigen, dat de ontwikkeling van een pathologische breuk en een significante aantasting van de botfunctie met zich meebrengt. Dergelijke patiënten hebben vaak problemen met chirurgische vervanging van het botweefseldefect en complicaties geassocieerd met niet-genezing van de breuk ontwikkelen.
Het gemiddelde overlevingspercentage van vijf jaar voor alle varianten van kwaadaardige osteoblastoclastomen bij zowel kinderen als volwassenen is 70%, wat als vrij goed kan worden beschouwd. Daarom kunnen we concluderen dat in veel gevallen dergelijke neoplasmata vrij succes zijn genezen. Natuurlijk zijn dergelijke punten als het type tumorproces, het stadium, de mate van laesie en maligniteit ook van groot belang.
Het is duidelijk dat het kwaadaardig osteoblastoclastoom is dat de grootste bedreiging vormt. In deze situatie kunnen we alleen over een gunstige prognose spreken in gevallen van vroege detectie, toegankelijke chirurgische lokalisatie, gevoeligheid van de focus voor chemopreventieve middelen en radiotherapie.

