Medisch expert van het artikel
Nieuwe publicaties
Oorzaken en pathogenese van difterie
Laatst beoordeeld: 04.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
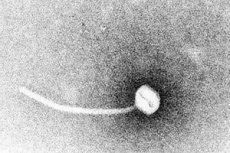
Difterie is een voorbeeld van toxigene infectieziekten. In 1883 toonde Klebs aan dat Corynebacterium diphtheriae de verwekker van difterie was. Een jaar later ontdekte Loeffler dat het organisme alleen uit de neuskeelholte gekweekt kon worden en stelde hij dat de schade aan inwendige organen te wijten was aan een oplosbaar toxine. In 1888 toonden Roux en Yersin aan dat dieren die geïnjecteerd waren met steriele filtraten van C. diphtheriae orgaanpathologie ontwikkelden die niet te onderscheiden was van die van menselijke difterie; dit toonde aan dat een krachtig exotoxine de belangrijkste virulentiefactor was.
Difterie is meestal een infectie van de bovenste luchtwegen die koorts, keelpijn en malaise veroorzaakt. Een dik, grijsgroen fibrinemembraan, een pseudomembraan, vormt zich vaak op de plaats(en) van de infectie als gevolg van de gecombineerde effecten van bacteriegroei, toxineproductie, onderliggende weefselnecrose en de immuunrespons van de gastheer. De erkenning dat systemische orgaanschade te wijten is aan de werking van difterietoxine heeft geleid tot de ontwikkeling van zowel effectieve antitoxinetherapie voor de behandeling van acute infecties als een zeer effectief toxoïdvaccin.
Hoewel vaccinatie met toxoïden difterie tot een zeldzame ziekte heeft gemaakt in gebieden waar vaccinatie volgens de volksgezondheidsnormen verplicht is, komen uitbraken van difterie nog steeds voor bij niet-geïmmuniseerde en immuungecompromitteerde groepen. Daarentegen hebben wijdverspreide uitbraken van difterie die epidemische proporties hebben aangenomen, plaatsgevonden in gebieden waar actieve vaccinatieprogramma's zijn opgeschort.
Andere soorten corynebacteriën
Naast C. diphtheriae, C. ulcerans en C. pseudotuberculosis kunnen C. pseudodiphtheriticum en C. xerosis incidenteel neus- en huidinfecties veroorzaken. De laatste twee stammen zijn herkenbaar aan hun vermogen om pyrazinamidase te produceren. In de diergeneeskunde zijn C. renale en C. kutscheri belangrijke pathogenen, die respectievelijk pyelonefritis bij runderen en latente infecties bij muizen veroorzaken.
Oorzaken
De verwekker van difterie, Corynebacterium diphtheriae, is een dun, licht gebogen staafje met knotsvormige verdikkingen aan de uiteinden, dat niet beweegt. Het vormt geen sporen, capsules of flagellen en is grampositief.
Naast het toxine produceren difteriecorynebacteriën tijdens hun levensprocessen neuraminidase, hyaluronidase, hemolysine, necrotiserende en diffuse factoren, die necrose en liquefactie van de hoofdsubstantie van het bindweefsel kunnen veroorzaken.
Op basis van hun vermogen om toxines te vormen, worden difteriecorynebacteriën onderverdeeld in toxigeen en niet-toxigeen.
Difterietoxine is een krachtige bacteriële exotoxine die zowel de algemene als de lokale klinische manifestaties van de ziekte bepaalt. Toxigeniciteit is genetisch bepaald. Niet-toxigene corynebacteriën van difterie veroorzaken de ziekte niet.
Volgens culturele en morfologische kenmerken worden alle difteriecorynebacteriën onderverdeeld in 3 varianten: gravis, mitis en intermedius. De ernst van de ziekte is niet direct afhankelijk van de variant van de difteriecorynebacteriën. Elke variant bevat zowel toxigene als niet-toxigene stammen. Toxigene corynebacteriën van alle varianten produceren een identiek toxine. [ 1 ]
Structuur, classificatie en antigeentypen
Corynebacterium diphtheriae is een grampositieve, niet-beweeglijke, knotsvormige staaf. Stammen die in weefsel of oudere in-vitroculturen groeien, bevatten fijne plekjes in de celwanden die ontkleuring tijdens gramkleuring mogelijk maken en resulteren in een variabele gramreactie. Oudere culturen bevatten vaak metachromatische korrels (polymetafosfaat) die blauwpaars kleuren met methyleenblauw. Celwandsuikers omvatten arabinose, galactose en mannose. Daarnaast kan de toxische 6,6'-ester van trehalose worden geïsoleerd, die corynemycolisch en corynemycoleenzuur in equimolaire concentraties bevat. Er worden drie verschillende kweektypen onderscheiden: mitis, intermedius en gravis.
De meeste soorten hebben nicotinezuur en pantotheenzuur nodig voor groei; sommige hebben ook thiamine, biotine of pimelinezuur nodig. Voor een optimale productie van difterietoxine moet het medium worden aangevuld met aminozuren en apart worden gezet.
Al in 1887 beschreef Loeffler de isolatie van avirulente (niet-toxigene) C. diphtheriae die niet te onderscheiden waren van virulente (toxigene) stammen die geïsoleerd waren bij gezonde patiënten. Tegenwoordig wordt erkend dat avirulente stammen van C. diphtheriae kunnen worden omgezet in een virulent fenotype na infectie en lysogenisatie door een van de verschillende corynebacteriofagen die het structurele gen voor difterietoxine, tox, dragen. Lysogene omzetting van het avirulente naar het virulente fenotype kan zowel in situ als in vitro plaatsvinden. Het structurele gen voor difterietoxine is niet essentieel voor corynebacteriofaag of C. diphtheriae. Ondanks deze observatie is er geen genetische drift van difterietoxine waargenomen.
Pathogenese
De infectie kan binnendringen via de slijmvliezen van de mond- en keelholte, neus en strottenhoofd, en soms ook via de slijmvliezen van de ogen en geslachtsorganen, evenals via beschadigde huid, wond- of brandwonden, luieruitslag en niet-genezende navelwonden. Op de plaats van binnendringing vermenigvuldigt de difteriecorynebacterie zich en scheidt exotoxine af.
Fibrinogeenrijk exsudaat wordt uitgescheiden en omgezet in fibrine onder invloed van trombokinase, dat vrijkomt bij necrose van epitheelcellen. Er ontstaat een fibrineuze film - een kenmerkend teken van difterie.
Asymptomatisch nasofaryngeaal dragerschap komt vaak voor in gebieden waar difterie endemisch is. Bij gevoelige personen veroorzaken toxigene stammen de ziekte door difterietoxine te repliceren en uit te scheiden in de nasofarynx of huidlaesies. De difterielaesie is vaak bedekt met een pseudomembraan bestaande uit fibrine, bacteriën en ontstekingscellen. Difterietoxine kan proteolytisch worden gesplitst in twee fragmenten: N-terminaal fragment A (katalytisch domein) en fragment B (transmembraan- en receptorbindende domeinen). Fragment A katalyseert de NAD+-afhankelijke ADP-ribosylering van elongatiefactor 2, waardoor de eiwitsynthese in eukaryotische cellen wordt geremd. Fragment B bindt zich aan een celoppervlakreceptor en faciliteert de afgifte van fragment A aan het cytosol.
Beschermende immuniteit omvat de antilichaamreactie tegen difterietoxine na klinische ziekte of tegen difterietoxine (toxine geïnactiveerd door formaldehyde) na immunisatie.
Kolonisatie
Er is weinig bekend over de factoren die de kolonisatie van C. diphtheriae bemiddelen. Het is echter duidelijk dat andere factoren dan de productie van difterietoxine bijdragen aan virulentie. Epidemiologische studies hebben aangetoond dat een bepaald lysotype lange tijd in een populatie kan blijven bestaan. Het kan later worden vervangen door een ander lysotype. De opkomst en daaropvolgende dominantie van een nieuw lysotype in een populatie houdt vermoedelijk verband met zijn vermogen om te koloniseren en effectief te concurreren in zijn segment van de nasofaryngeale ecologische niche. Corynebacterium diphtheriae kan neuraminidase produceren, dat siaalzuur op het celoppervlak splitst in de componenten pyruvaat en N-acetylneuraminezuur. Cordfactor (6,6'-di-O-mycoloyl-α, α'-D-trehalose) is een oppervlaktecomponent van C. diphtheriae, maar zijn rol bij de kolonisatie van de menselijke gastheer is onduidelijk.
Productie van difterietoxinen
Het structurele gen van difterietoxine, tox, behoort tot een familie van nauw verwante corynebacteriofagen, waarvan de β-faag het best bestudeerd is. De regulatie van de expressie van difterietoxine wordt gemedieerd door een ijzergeactiveerde repressor, DtxR, die gecodeerd wordt door het genoom van C. diphtheriae. De expressie van toxines is afhankelijk van de fysiologische toestand van C. diphtheriae. Onder omstandigheden waarin ijzer het groeisnelheidsbeperkende substraat wordt, dissocieert ijzer van DtxR, wordt het toxicodendrongen geactiveerd en wordt difterietoxine gesynthetiseerd en met maximale snelheid in het kweekmedium uitgescheiden.
Difterietoxine is uitzonderlijk krachtig; voor gevoelige soorten (bijv. mensen, apen, konijnen, cavia's) is een dosis van slechts 100 tot 150 ng/kg lichaamsgewicht dodelijk. Difterietoxine bestaat uit een enkele polypeptideketen van 535 aminozuren. Biochemische, genetische en röntgenstructuuranalyse tonen aan dat het toxine uit drie structurele/functionele domeinen bestaat:
- N-terminale ADP-ribosyltransferase (katalytisch domein);
- een regio die de overdracht van het katalytische domein door het celmembraan vergemakkelijkt (transmembraandomein);
- eukaryote celreceptorbindingsdomein.
Na milde trypsinevertering en reductie onder denaturerende omstandigheden kan difterietoxine specifiek worden gesplitst in twee polypeptidefragmenten (A en B) aan de proteasegevoelige lus. Fragment A is de N-terminale 21 kDa component van het toxine en bevat de katalytische plaats voor ADP-ribosylering van elongatiefactor 2 (EF-2).
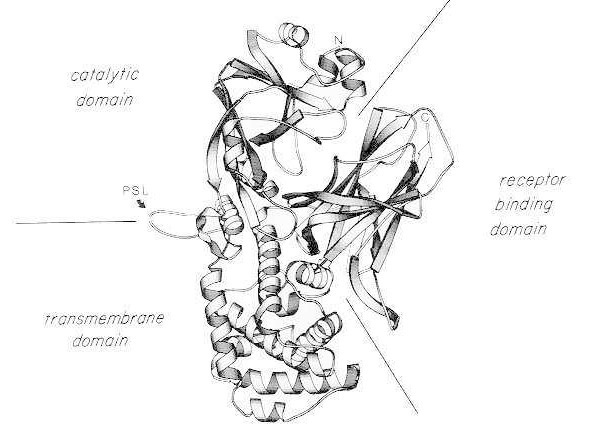
Lintdiagram van de röntgenkristalstructuur van monomeer natief difterietoxine. (gewijzigd naar Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling aliances between protein. Proc Natl Acad Sci, USA, 91: 3127, 1994). De relatieve posities van de katalytische, transmembraan- en receptorbindende domeinen worden weergegeven. Het intacte toxine kan worden gesplitst door trypsine-achtige proteasen op Arg190, Arg192 en/of Arg193, die zich in de protease-gevoelige lus (PSL) bevinden. Na reductie van de disulfidebrug tussen Cys186 en Cys201 kan het toxine worden gesplitst in A- en B-fragmenten. De aminoterminus (N) en carboxyterminus (C) van het intacte toxine worden weergegeven. De stripgrafiek is gemaakt met behulp van het programma MOLESCRIPT.
Het C-terminale fragment, fragment B, draagt de transmembraan- en receptorbindende domeinen van het toxine.
Vergiftiging van een enkele eukaryote cel door difterietoxine omvat minstens vier verschillende stappen:
- binding van het toxine aan zijn receptor op het celoppervlak;
- clustering van geladen receptoren in gecoate putjes en internalisatie van het toxine via receptor-gemedieerde endocytose; na verzuring van het endocytische blaasje door een membraan-geassocieerde, ATP-aangedreven protonpomp,
- invoeging van het transmembraandomein in het membraan en vergemakkelijkte de afgifte van het katalytische domein in het cytosol, en
- ADP-ribosylering van EF-2, resulterend in onomkeerbare onderdrukking van de eiwitsynthese.
Er is aangetoond dat één enkel molecuul van het katalytische domein, dat in het cytosol wordt afgeleverd, voldoende is om dodelijk te zijn voor de cel.
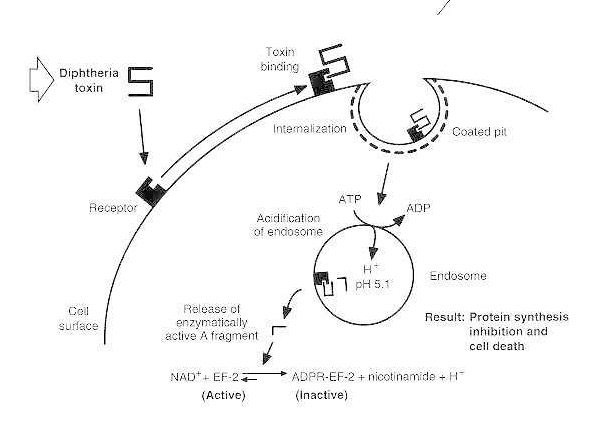
Schematische weergave van difterie-intoxicatie van een vatbare eukaryote cel.
Het toxine bindt zich aan de receptor op het celoppervlak en wordt opgenomen via receptor-gemedieerde endocytose; na verzuring van het endosoom wordt het transmembraandomein ingevoegd in het vesikelmembraan; het katalytische domein wordt naar het cytosol gebracht, wat leidt tot remming van de eiwitsynthese en celdood.
Epidemiologie
Vóór massale immunisatie van de Amerikaanse bevolking met difterietoxoïd was difterie meestal een kinderziekte. Een opmerkelijk aspect van massale immunisatie met difterietoxoïd is dat naarmate het percentage van de bevolking met beschermende niveaus van antitoxine-immuniteit (≥ 0,01 IE/ml) toeneemt, de frequentie van isolatie van toxigene stammen uit de bevolking afneemt. Tegenwoordig is isolatie van toxigene stammen van C. diphtheriae in de Verenigde Staten, waar klinische difterie bijna volledig is verdwenen, zeldzaam. Omdat subklinische infectie geen bron van blootstelling aan difterie-antigeen meer biedt en, tenzij versterkt, de immuniteit tegen antitoxine afneemt, heeft een groot percentage volwassenen (30 tot 60%) antitoxineniveaus die onder het beschermende niveau liggen en lopen zij risico. In de Verenigde Staten, Europa en Oost-Europa hebben recente uitbraken van difterie zich voornamelijk voorgedaan bij personen die alcohol en/of drugs misbruiken. Binnen deze groep hebben dragers van toxigene C. diphtheriae een matig hoge antitoxische immuniteit. De recente afschaffing van de volksgezondheidsmaatregelen in Rusland heeft ertoe geleid dat difterie een epidemie is geworden. Eind 1994 waren er in Rusland meer dan 80.000 gevallen en meer dan 2.000 sterfgevallen gemeld.
Focale uitbraken van difterie worden bijna altijd geassocieerd met een immuundrager die is teruggekeerd uit een regio waar difterie endemisch is. Recente uitbraken van klinische difterie in de Verenigde Staten en Europa zijn inderdaad in verband gebracht met reizigers die terugkeren uit Rusland en Oost-Europa. Toxigene stammen van C. diphtheriae worden rechtstreeks van persoon op persoon overgedragen via druppeltjes in de lucht. Het is bekend dat toxigene stammen de neuskeelholte direct kunnen koloniseren. Bovendien kan het toxigene gen indirect worden verspreid door de afgifte van toxigene corynebacteriofaag en lysogene transformatie van niet-toxigene autochtone C. diphtheriae in situ. [ 5 ]
Naast biotype- en lysotypebepaling van C. diphtheriae-isolaten kunnen moleculair-biologische technieken nu ook worden gebruikt om difterie-uitbraken te bestuderen. Restrictie-endonuclease-digestiepatronen van C. diphtheriae-chromosomaal DNA zijn gebruikt om klinische uitbraken te bestuderen, evenals het gebruik van gekloonde corynebacteriële insertiesequenties als genetische probe.
De Schick-test wordt al jaren gebruikt om de immuniteit tegen difterietoxine te beoordelen, hoewel deze inmiddels in veel gebieden is vervangen door de serologische test voor specifieke antilichamen tegen difterietoxine. Bij de Schick-test wordt een kleine hoeveelheid difterietoxine (ongeveer 0,8 ng in 0,2 ml) intradermaal in de onderarm (testplaats) geïnjecteerd en 0,0124 μg difterietoxine in 0,2 ml wordt intradermaal in de controleplaats geïnjecteerd. De metingen worden uitgevoerd na 48 en 96 uur. Niet-specifieke huidreacties bereiken gewoonlijk hun hoogtepunt na 48 uur. Na 96 uur duidt een erythemateuze reactie met mogelijke necrose op de testplaats op een onvoldoende antitoxische immuniteit om de toxine te neutraliseren (≤ 0,03 IE/ml). Ontstekingen in zowel het test- als het controlegebied na 48 uur duiden op een overgevoeligheidsreactie op het antigeenpreparaat.
Vormen
Corynebacterium diphtheriae infecteert de neuskeelholte of de huid. Toxigene stammen produceren een krachtig exotoxine dat difterie kan veroorzaken. Symptomen van difterie zijn onder andere faryngitis, koorts en zwelling van de nek of het gebied rond de huidlaesie. Difterielaesies zijn bedekt met een pseudomembraan. Het toxine verspreidt zich via de bloedbaan naar afgelegen organen en kan verlamming en congestief hartfalen veroorzaken. [ 6 ]
Er zijn twee soorten klinische difterie: nasofaryngeale en cutane difterie. De symptomen van faryngeale difterie variëren van milde faryngitis tot hypoxie als gevolg van luchtwegobstructie door een pseudomembraan. Betrokkenheid van de cervicale lymfeklieren kan ernstige zwelling van de nek (bull's neck difterie) veroorzaken, en de patiënt kan koorts ontwikkelen (≥ 39°C). Huidlaesies bij cutane difterie zijn meestal bedekt met een grijsbruin pseudomembraan. Levensbedreigende systemische complicaties, met name verlies van motorische functie (bijv. slikproblemen) en congestief hartfalen, kunnen ontstaan als gevolg van de werking van difterietoxine op perifere motorneuronen en de hartspier.
Controle
De bestrijding van difterie is afhankelijk van adequate immunisatie met difterietoxoïd: difterietoxine geïnactiveerd door formaldehyde, dat antigeen intact blijft. Het toxoïd wordt bereid door difterietoxine te incuberen met formaldehyde bij 37 °C onder alkalische omstandigheden. Difterie-immunisatie moet beginnen in de tweede levensmaand met een reeks van drie primaire doses met tussenpozen van 4 tot 8 weken, gevolgd door een vierde dosis ongeveer 1 jaar na de laatste primaire. Difterietoxoïd wordt veel gebruikt als onderdeel van het difterie-kinkhoest-tetanus (DKT)-vaccin. Epidemiologische studies hebben aangetoond dat immunisatie tegen difterie ongeveer 97% effectief is. Hoewel massale immunisatie tegen difterie wordt toegepast in de Verenigde Staten en Europa en de immunisatiepercentages bij kinderen adequaat zijn, kan een groot deel van de volwassen bevolking antilichaamtiters hebben die onder het beschermende niveau liggen. Volwassenen moeten elke 10 jaar opnieuw worden gevaccineerd met difterietoxoïd. Een boostervaccinatie met difterie-tetanustoxoïd dient te worden gegeven aan reizigers naar gebieden met een hoge incidentie van endemische difterie (Centraal- en Zuid-Amerika, Afrika, Azië, Rusland en Oost-Europa). In de afgelopen jaren heeft het gebruik van zeer zuivere toxoïdpreparaten voor immunisatie het aantal incidentele ernstige overgevoeligheidsreacties geminimaliseerd. Een boostervaccinatie met difterie-tetanustoxoïd dient te worden gegeven aan reizigers naar gebieden met een hoge incidentie van endemische difterie (Centraal- en Zuid-Amerika, Afrika, Azië, Rusland en Oost-Europa). In de afgelopen jaren heeft het gebruik van zeer zuivere toxoïdpreparaten voor immunisatie het aantal incidentele ernstige overgevoeligheidsreacties geminimaliseerd. Een boostervaccinatie met difterie-tetanustoxoïd dient te worden gegeven aan reizigers naar gebieden met een hoge incidentie van endemische difterie (Centraal- en Zuid-Amerika, Afrika, Azië, Rusland en Oost-Europa). Door de toepassing van zeer zuivere toxoïdepreparaten voor immunisatie is het aantal incidentele ernstige overgevoeligheidsreacties de laatste jaren tot een minimum beperkt.
Hoewel antibiotica (zoals penicilline en erytromycine) worden gebruikt als onderdeel van de behandeling van patiënten met difterie, is snelle passieve immunisatie met difterie-antitoxine het meest effectief in het verminderen van sterfte. De lange halfwaardetijd van een specifiek antitoxine in de bloedbaan is een belangrijke factor voor een effectieve neutralisatie van difterietoxine; om effectief te zijn, moet het antitoxine echter met het toxine reageren voordat het de cel kan binnendringen.
Herontwerp van difterietoxine voor de ontwikkeling van eukaryote receptor-specifieke cytotoxinen
Eiwitengineering is een nieuw en snel ontwikkelend vakgebied binnen de moleculaire biologie; het combineert recombinant-DNA-methodologieën en vaste-fase-DNA-synthese om chimere genen te ontwerpen en te construeren waarvan de producten unieke eigenschappen hebben. Studies naar de structuur-functierelaties van difterietoxine hebben duidelijk aangetoond dat dit toxine een eiwit met drie domeinen is: katalytisch, transmembraan en receptor. Het is mogelijk gebleken om het oorspronkelijke receptorbindende domein van difterietoxine genetisch te vervangen door diverse polypeptidehormonen en cytokinen (bijvoorbeeld α-melanocytstimulerend hormoon [α-MSH], interleukine (IL) 2, IL-4, IL-6, IL-7, epidermale groeifactor). De resulterende chimere eiwitten of fusietoxinen combineren de receptorbindende specificiteit van het cytokine met de transmembraan- en katalytische domeinen van het toxine. In elk geval bleek dat de fusietoxinen selectief alleen die cellen vergiftigen die de corresponderende doelreceptor dragen. De eerste van deze genetisch gemodificeerde fusietoxinen, DAB 389IL-2, wordt momenteel geëvalueerd in klinische studies bij mensen voor de behandeling van refractaire lymfomen en auto-immuunziekten waarbij cellen met IL-2-receptoren met hoge affiniteit een belangrijke rol spelen in de pathogenese.[ 7 ] Toediening van DAB 389 IL-2 is veilig gebleken, goed verdragen en in staat om duurzame ziekteremissie te induceren zonder ernstige bijwerkingen. Het is waarschijnlijk dat fusietoxinen op basis van difterietoxine belangrijke nieuwe biologische middelen zullen worden voor de behandeling van specifieke tumoren of ziekten waarbij specifieke celoppervlakreceptoren kunnen worden aangevallen.


 [
[