Medisch expert van het artikel
Nieuwe publicaties
Synthese, secretie en metabolisme van catecholaminen
Laatst beoordeeld: 06.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Het bijniermerg produceert verbindingen met een structuur die ver afstaat van die van steroïden. Ze bevatten een 3,4-dihydroxyfenyl (catechol) kern en worden catecholamines genoemd. Deze omvatten adrenaline, noradrenaline en dopamine bèta-hydroxytyramine.
De volgorde van de synthese van catecholamines is vrij eenvoudig: tyrosine → dihydroxyfenylalanine (DOPA) → dopamine → noradrenaline → adrenaline. Tyrosine komt het lichaam binnen via voedsel, maar kan ook in de lever uit fenylalanine worden gevormd onder invloed van fenylalaninehydroxylase. De eindproducten van de omzetting van tyrosine in weefsels zijn verschillend. In het bijniermerg gaat het proces verder tot de vorming van adrenaline, in de uiteinden van de sympathische zenuwen - noradrenaline, en in sommige neuronen van het centrale zenuwstelsel eindigt de synthese van catecholamines met de vorming van dopamine.
De omzetting van tyrosine in DOPA wordt gekatalyseerd door tyrosinehydroxylase, waarvan tetrahydrobiopterine en zuurstof de cofactoren zijn. Aangenomen wordt dat dit enzym de snelheid van het gehele proces van catecholaminebiosynthese beperkt en wordt geremd door de eindproducten van het proces. Tyrosinehydroxylase is het belangrijkste doelwit van regulerende effecten op de catecholaminebiosynthese.
De omzetting van DOPA in dopamine wordt gekatalyseerd door het enzym DOPA-decarboxylase (cofactor - pyridoxaalfosfaat), dat relatief niet-specifiek is en andere aromatische L-aminozuren decarboxyleert. Er zijn echter aanwijzingen voor de mogelijkheid om de synthese van catecholamines te modificeren door de activiteit van dit enzym te veranderen. Sommige neuronen missen enzymen voor de verdere omzetting van dopamine, en het is het eindproduct. Andere weefsels bevatten dopamine-bèta-hydroxylase (cofactoren - koper, ascorbinezuur en zuurstof), dat dopamine omzet in noradrenaline. In het bijniermerg (maar niet in de uiteinden van de sympathische zenuwen) is fenylethanolamine aanwezig - een methyltransferase die adrenaline vormt uit noradrenaline. In dit geval dient S-adenosylmethionine als donor van methylgroepen.
Het is belangrijk om te onthouden dat de synthese van fenylethanolamine-N-methyltransferase wordt geïnduceerd door glucocorticoïden die de medulla binnendringen vanuit de cortex via het portale veneuze systeem. Dit zou kunnen verklaren waarom twee verschillende endocriene klieren in één orgaan gecombineerd zijn. Het belang van glucocorticoïden voor de synthese van adrenaline wordt benadrukt door het feit dat de cellen van het bijniermerg die noradrenaline produceren zich rond de arteriële vaten bevinden, terwijl de adrenalineproducerende cellen voornamelijk bloed ontvangen vanuit de veneuze sinussen in de bijnierschors.
De afbraak van catecholamines vindt voornamelijk plaats onder invloed van twee enzymsystemen: catechol-O-methyltransferase (COMT) en monoamineoxidase (MAO). De belangrijkste afbraakroutes van adrenaline en noradrenaline zijn schematisch weergegeven in figuur 54. Onder invloed van COMT, in aanwezigheid van de methylgroepdonor S-adrenosylmethionine, worden catecholamines omgezet in normetanefrine en metanephrine (3-O-methylderivaten van noradrenaline en adrenaline), die onder invloed van MAO worden omgezet in aldehyden en vervolgens (in aanwezigheid van aldehydeoxidase) in vanillylamandelzuur (VMA), het belangrijkste afbraakproduct van noradrenaline en adrenaline. In hetzelfde geval worden catecholamines, wanneer ze eerst worden blootgesteld aan MAO in plaats van COMT, omgezet in 3,4-dioxomandelaldehyde en vervolgens, onder invloed van aldehydeoxidase en COMT, in 3,4-dioxomandelzuur en VMC. In aanwezigheid van alcoholdehydrogenase kan uit catecholamines 3-methoxy-4-oxyfenylglycol worden gevormd, het belangrijkste eindproduct van de afbraak van adrenaline en noradrenaline in het centrale zenuwstelsel.
De afbraak van dopamine verloopt op vergelijkbare wijze. Het enige verschil is dat de metabolieten de hydroxylgroep op het bètakoolstofatoom missen. In plaats van vanillylamandelzuur wordt er homovanillinezuur (HVA) of 3-methoxy-4-hydroxyfenylazijnzuur gevormd.
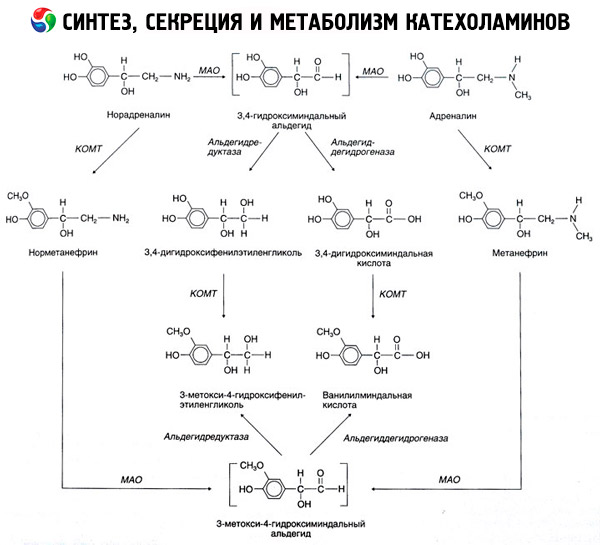
Er wordt ook verondersteld dat er een quinoïde oxidatieroute bestaat voor het catecholaminemolecuul, die tussenproducten met een uitgesproken biologische activiteit kan opleveren.
Noradrenaline en adrenaline, gevormd onder invloed van cytosolische enzymen in de sympathische zenuwuiteinden en het bijniermerg, dringen de secretoire granula binnen, waardoor deze beschermd worden tegen de werking van afbraakenzymen. Het opnemen van catecholamines door de granula vereist energieverbruik. In de chromaffinegranula van het bijniermerg zijn catecholamines sterk gebonden aan ATP (in een verhouding van 4:1) en specifieke eiwitten - chromograninen - waardoor de diffusie van hormonen vanuit de granula naar het cytoplasma wordt voorkomen.
De directe prikkel voor de secretie van catecholamines is kennelijk de penetratie van calcium in de cel, waardoor de exocytose (versmelting van het korrelmembraan met het celoppervlak en het verbreken van de membraan, met het volledig vrijkomen van de oplosbare inhoud - catecholamines, dopamine bèta-hydroxylase, ATP en chromogranines - in de extracellulaire vloeistof) wordt gestimuleerd.
Fysiologische effecten van catecholamines en hun werkingsmechanisme
De effecten van catecholamines beginnen met de interactie met specifieke receptoren van doelcellen. Terwijl receptoren voor schildklier- en steroïde hormonen zich in de cel bevinden, bevinden receptoren voor catecholamines (en acetylcholine- en peptidehormonen) zich aan de buitenkant van de cel.
Het is al lang vastgesteld dat adrenaline of noradrenaline bij sommige reacties effectiever zijn dan de synthetische catecholamine isoproterenol, terwijl bij andere reacties het effect van isoproterenol superieur is aan de werking van adrenaline of noradrenaline. Op basis hiervan werd een concept ontwikkeld over de aanwezigheid van twee soorten adrenoreceptoren in weefsels: alfa en bèta, en in sommige weefsels kan slechts één van deze twee typen aanwezig zijn. Isoproterenol is de krachtigste agonist van bèta-adrenoreceptoren, terwijl de synthetische verbinding fenylefrine de krachtigste agonist van alfa-adrenoreceptoren is. Natuurlijke catecholamines - adrenaline en noradrenaline - kunnen interacteren met receptoren van beide typen, maar adrenaline vertoont een grotere affiniteit voor bèta- en noradrenalinereceptoren.
Catecholamines activeren bèta-adrenerge receptoren in het hart sterker dan bèta-adrenerge receptoren in glad spierweefsel, waardoor het bètatype onderverdeeld kon worden in subtypes: bèta1-receptoren (hart, vetcellen) en bèta2-receptoren (bronchiën, bloedvaten, enz.). Het effect van isoproterenol op bèta1-receptoren overtreft het effect van adrenaline en noradrenaline slechts 10 keer, terwijl het op bèta2-receptoren 100-1000 keer sterker werkt dan natuurlijke catecholamines.
Het gebruik van specifieke antagonisten (fentolamine en fenoxybenzamine voor alfa- en propranolol voor bèta-receptoren) bevestigde de adequaatheid van de classificatie van adrenoreceptoren. Dopamine kan interageren met zowel alfa- als bèta-receptoren, maar verschillende weefsels (hersenen, hypofyse, bloedvaten) hebben ook hun eigen dopaminerge receptoren, waarvan haloperidol de specifieke blokker is. Het aantal bèta-receptoren varieert van 1000 tot 2000 per cel. De biologische effecten van catecholamines gemedieerd door bèta-receptoren worden gewoonlijk geassocieerd met de activering van adenylaatcyclase en een toename van de intracellulaire hoeveelheid cAMP. Hoewel de receptor en het enzym functioneel verbonden zijn, zijn het verschillende macromoleculen. Guanosinetrifosfaat (GTP) en andere purinenucleotiden nemen deel aan de modulering van adenylaatcyclase-activiteit onder invloed van het hormoon-receptorcomplex. Door de enzymactiviteit te verhogen, lijken ze de affiniteit van bèta-receptoren voor agonisten te verminderen.
Het fenomeen van verhoogde gevoeligheid van gedenerveerde structuren is al lang bekend. Integendeel, langdurige blootstelling aan agonisten vermindert de gevoeligheid van doelweefsels. De studie van bètareceptoren heeft het mogelijk gemaakt deze verschijnselen te verklaren. Het is aangetoond dat langdurige blootstelling aan isoproterenol leidt tot een verlies van gevoeligheid van adenylaatcyclase door een afname van het aantal bètareceptoren.
Het desensibilisatieproces vereist geen activering van de eiwitsynthese en is waarschijnlijk het gevolg van de geleidelijke vorming van onomkeerbare hormoon-receptorcomplexen. Integendeel, de introductie van 6-oxidopamine, dat sympathische uiteinden vernietigt, gaat gepaard met een toename van het aantal reagerende bètareceptoren in weefsels. Het is mogelijk dat een toename van de sympathische zenuwactiviteit ook leeftijdsgebonden desensibilisatie van bloedvaten en vetweefsel veroorzaakt ten opzichte van catecholamines.
Het aantal adrenoreceptoren in verschillende organen kan worden gereguleerd door andere hormonen. Zo verhoogt oestradiol en verlaagt progesteron het aantal alfa-adrenoreceptoren in de baarmoeder, wat gepaard gaat met een overeenkomstige toename en afname van de contractiele respons op catecholamines. Als de intracellulaire "tweede boodschapper" die wordt gevormd door de werking van bèta-receptoragonisten zeker cAMP is, dan is de situatie met betrekking tot de transmitter van alfa-adrenerge effecten ingewikkelder. Er wordt aangenomen dat er verschillende mechanismen bestaan: een verlaging van het cAMP-niveau, een verhoging van het cAMP-gehalte, modulatie van de cellulaire calciumdynamiek, enz.
Om verschillende effecten in het lichaam te reproduceren, zijn doses adrenaline meestal nodig die 5-10 keer kleiner zijn dan noradrenaline. Hoewel noradrenaline effectiever is met betrekking tot a- en bèta1-adrenoreceptoren, is het belangrijk om te onthouden dat beide endogene catecholamines in staat zijn om te interageren met zowel alfa- als bèta-receptoren. De biologische respons van een bepaald orgaan op adrenerge activering hangt daarom grotendeels af van het type receptoren dat erin aanwezig is. Dit betekent echter niet dat selectieve activering van de zenuw- of humorale verbinding van het sympathisch-bijnierstelsel onmogelijk is. In de meeste gevallen wordt een verhoogde activiteit van de verschillende verbindingen waargenomen. Het is dus algemeen aanvaard dat hypoglykemie reflexmatig de bijniermerg activeert, terwijl een bloeddrukdaling (posturale hypotensie) voornamelijk gepaard gaat met de afgifte van noradrenaline uit de uiteinden van de sympathische zenuwen.
Adrenoreceptoren en de effecten van hun activering in verschillende weefsels
Systeem, orgaan |
Adrenerge receptor type |
Reactie |
Cardiovasculair systeem: |
||
Hart |
Bèta |
Verhoogde hartslag, geleidbaarheid en contractiliteit |
Arteriolen: |
||
Huid en slijmvliezen |
Alfa |
Afname |
Skeletspieren |
Bèta |
Uitbreiding Contractie |
Buikorganen |
Alpha (meer) |
Afname |
Bèta |
Verlenging |
|
Aderen |
Alfa |
Afname |
Ademhalingsstelsel: |
||
Spieren van de bronchiën |
Bèta |
Verlenging |
Spijsverteringsstelsel: |
||
Maag |
Bèta |
Verminderde motoriek |
Ingewanden |
Alfa |
Samentrekking van de sluitspieren |
Milt |
Alfa |
Afname |
Bèta |
Ontspanning |
|
Exocriene pancreas |
Alfa |
Verminderde secretie |
Urogenitaal systeem: |
Alfa |
Sluitspiercontractie |
Blaas |
Bèta |
Ontspanning van de ejector spier |
Mannelijke geslachtsdelen |
Alfa |
Ejaculatie |
Ogen |
Alfa |
Pupilverwijding |
Leer |
Alfa |
Toenemend zweten |
Speekselklieren |
Alfa |
Uitscheiding van kalium en water |
Bèta |
Amylase secretie |
|
Endocriene klieren: |
||
Eilandjes van de alvleesklier |
||
Bètacellen |
Alpha (meer) |
Verminderde insulinesecretie |
Bèta |
Verhoogde insulinesecretie |
|
Alfacellen |
Bèta |
Verhoogde glucagonafscheiding |
8-cellen |
Bèta |
Verhoogde secretie van somatostatine |
Hypothalamus en hypofyse: |
||
Somatotrofen |
Alfa |
Verhoogde secretie van STH |
Bèta |
Verminderde secretie van STH |
|
Lactotrofen |
Alfa |
Verminderde uitscheiding van prolactine |
Thyrotrofen |
Alfa |
Verminderde TSH-secretie |
Corticotrofen |
Alfa |
Verhoogde ACTH-secretie |
| bèta | Verminderde ACTH-secretie | |
Schildklier: |
||
Folliculaire cellen |
Alfa |
Verminderde uitscheiding van thyroxine |
Bèta |
Verhoogde uitscheiding van thyroxine |
|
Parafolliculaire (K) cellen |
Bèta |
Verhoogde uitscheiding van calcitonine |
Bijschildklieren |
Bèta |
Verhoogde secretie van PTH |
Nieren |
Bèta |
Verhoogde reninesecretie |
Maag |
Bèta |
Verhoogde gastrine-uitscheiding |
BX |
Bèta |
Verhoogd zuurstofverbruik |
Lever |
? |
Verhoogde glycogenolyse en gluconeogenese met de vrijgave van glucose; verhoogde ketogenese met de vrijgave van ketonlichamen |
Vetweefsel |
Bèta |
Verhoogde lipolyse met de vrijgave van vrije vetzuren en glycerol |
Skeletspieren |
Bèta |
Verhoogde glycolyse met de vrijgave van pyruvaat en lactaat; verminderde proteolyse met een afname van de vrijgave van alanine en glutamine |
Het is belangrijk om er rekening mee te houden dat de resultaten van intraveneuze toediening van catecholamines niet altijd de effecten van endogene verbindingen adequaat weerspiegelen. Dit geldt met name voor noradrenaline, aangezien dit in het lichaam voornamelijk niet in het bloed, maar rechtstreeks in de synaptische spleten wordt afgegeven. Endogene noradrenaline activeert daarom bijvoorbeeld niet alleen vasculaire alfa-receptoren (verhoogde bloeddruk), maar ook bèta-receptoren van het hart (verhoogde hartslag), terwijl de toediening van noradrenaline van buitenaf voornamelijk leidt tot de activering van vasculaire alfa-receptoren en een reflexmatige (via de vagus) vertraging van de hartslag.
Lage doses adrenaline activeren voornamelijk bèta-receptoren van spiervaten en het hart, wat resulteert in een afname van de perifere vaatweerstand en een toename van het hartminuutvolume. In sommige gevallen kan het eerste effect overheersen en ontwikkelt zich hypotensie na toediening van adrenaline. Bij hogere doses activeert adrenaline ook alfa-receptoren, wat gepaard gaat met een toename van de perifere vaatweerstand en, tegen de achtergrond van een toename van het hartminuutvolume, leidt tot een toename van de arteriële druk. Het effect op vasculaire bèta-receptoren blijft echter ook behouden. Als gevolg hiervan overtreft de toename van de systolische druk de vergelijkbare indicator van de diastolische druk (toename van de polsdruk). Met de introductie van nog hogere doses beginnen de alfa-mimetische effecten van adrenaline te overheersen: de systolische en diastolische druk nemen parallel toe, zoals onder invloed van noradrenaline.
Het effect van catecholamines op de stofwisseling bestaat uit hun directe en indirecte effecten. De eerste worden voornamelijk gerealiseerd via bètareceptoren. Complexere processen zijn geassocieerd met de lever. Hoewel verhoogde leverglycogenolyse traditioneel wordt beschouwd als het gevolg van bètareceptoractivering, zijn er ook aanwijzingen voor de betrokkenheid van alfareceptoren. Indirecte effecten van catecholamines worden geassocieerd met de modulatie van de secretie van veel andere hormonen, zoals insuline. In het effect van adrenaline op de secretie ervan overheerst de alfa-adrenerge component duidelijk, aangezien is aangetoond dat elke stress gepaard gaat met remming van de insulinesecretie.
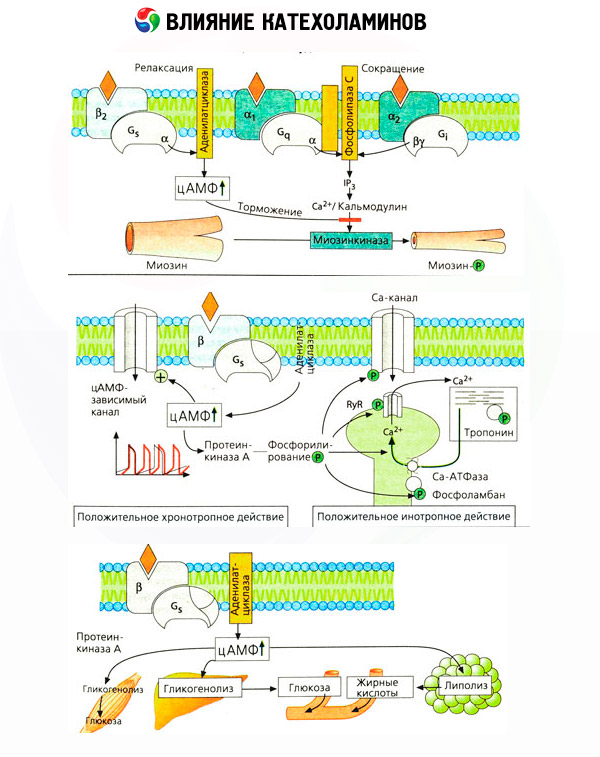
De combinatie van directe en indirecte effecten van catecholamines veroorzaakt hyperglykemie, die niet alleen gepaard gaat met een verhoogde glucoseproductie in de lever, maar ook met een remming van het gebruik ervan door perifere weefsels. Versnelling van de lipolyse veroorzaakt hyperlipacidemie met een verhoogde afgifte van vetzuren aan de lever en intensivering van de productie van ketonlichamen. Verhoogde glycolyse in de spieren leidt tot een verhoogde afgifte van lactaat en pyruvaat in het bloed, die samen met glycerol uit vetweefsel dienen als voorlopers van de gluconeogenese in de lever.
Regulering van de catecholaminesecretie. De gelijkenis van de reactieproducten en -methoden van het sympathische zenuwstelsel en het bijniermerg vormde de basis voor de combinatie van deze structuren tot één sympathisch-bijnierstelsel van het lichaam, met de toewijzing van de zenuw- en hormonale verbindingen. Verschillende afferente signalen zijn geconcentreerd in de hypothalamus en de centra van het ruggenmerg en de medulla oblongata, van waaruit efferente signalen afkomstig zijn en overgaan naar de cellichamen van preganglionaire neuronen in de laterale hoorns van het ruggenmerg ter hoogte van de VIII cervicale - II-III lumbale segmenten.
De preganglionaire axonen van deze cellen verlaten het ruggenmerg en vormen synaptische verbindingen met neuronen in de ganglia van de sympathische zenuwketen of met cellen van het bijniermerg. Deze preganglionaire vezels zijn cholinerg. Het eerste fundamentele verschil tussen sympathische postganglionaire neuronen en chromaffiene cellen van het bijniermerg is dat laatstgenoemde het door hen ontvangen cholinerge signaal niet via zenuwgeleiding (postganglionaire adrenerge zenuwen) doorgeven, maar via de humorale route, waarbij adrenerge stoffen in het bloed worden afgegeven. Het tweede verschil is dat postganglionaire zenuwen noradrenaline produceren, terwijl cellen van het bijniermerg voornamelijk adrenaline produceren. Deze twee stoffen hebben verschillende effecten op weefsels.

