Medisch expert van het artikel
Nieuwe publicaties
Taaislijmziekte
Laatst beoordeeld: 04.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Cystic fibrosis is een genetische autosomaal recessieve monogene ziekte die gekenmerkt wordt door een stoornis in de secretie van exocriene klieren van vitale organen met voornamelijk schade aan het ademhalings- en spijsverteringsstelsel, met een ernstig beloop en een ongunstige prognose.
 [ 1 ]
[ 1 ]
Epidemiologie
De incidentie van cystic fibrosis (taaislijmziekte) schommelt tussen 1:2500 en 1:4600 pasgeborenen. Jaarlijks worden wereldwijd ongeveer 45.000 mensen met cystic fibrosis geboren. De incidentie van dragers van het cystic fibrosis-gen is 3-4%, met ongeveer 275 miljoen mensen wereldwijd die drager zijn van dit gen, waarvan ongeveer 5 miljoen in Rusland en ongeveer 12,5 miljoen in de GOS-landen.
Oorzaken taaislijmziekte
Cystic fibrosis wordt autosomaal recessief overgedragen. Het gen voor cystic fibrosis bevindt zich in autosoom 7, bevat 27 exonen en bestaat uit 250.000 nucleotideparen.
Eén enkel gen kan meerdere mutaties hebben, die elk specifiek zijn voor een bepaalde populatie of geografische regio. Er zijn meer dan 520 mutaties beschreven, waarvan delta-P-508 de meest voorkomende is, een substitutie van het aminozuur fenylalanine op positie 508.
Pathogenese
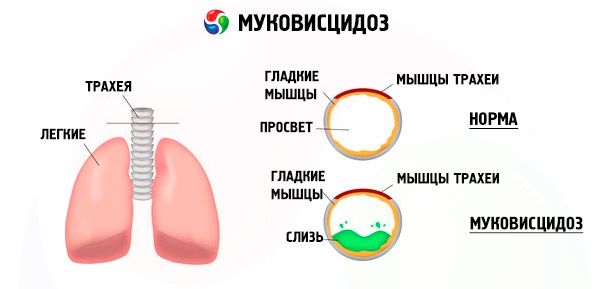
Mutaties in het cystic fibrosis-gen verstoren de structuur en functie van een eiwit genaamd CFTR (cystic fibrosis transmembrane regulator). Dit eiwit fungeert als een chloridekanaal dat betrokken is bij de uitwisseling van water en elektrolyten tussen epitheelcellen van het bronchopulmonale systeem, het maag-darmkanaal, de pancreas, de lever en het voortplantingsstelsel. Als gevolg van de verstoring van de functie en structuur van het CFTR-eiwit hopen chloride-ionen (Cl- ) zich op in de cel. Dit leidt tot een verandering in het elektrische potentiaal in het lumen van de uitscheidingsbuizen, wat de stroom van grote hoeveelheden natriumionen (Na + ) vanuit het lumen van de buis naar de cel vergemakkelijkt en de absorptie van water uit de pericellulaire ruimte verder verbetert.
Deze veranderingen hebben tot gevolg dat de afscheiding van de meeste exocriene klieren dikker wordt en de afvoer ervan verstoord raakt. Dit leidt tot duidelijke secundaire stoornissen in organen en systemen, die het meest uitgesproken zijn in de bronchopulmonale en spijsverteringsstelsels.
Er ontwikkelt zich een chronisch ontstekingsproces van wisselende intensiteit in de bronchiën, de functie van het trilhaarepitheel wordt abrupt verstoord, het sputum wordt zeer viskeus, dik en zeer moeilijk te evacueren, er treedt stagnatie op, er ontstaan bronchiolo- en bronchiëctasieën, die na verloop van tijd vaker voorkomen. Deze veranderingen leiden tot een toename van hypoxie en het ontstaan van chronische longaandoeningen.
Patiënten met cystische fibrose zijn extreem vatbaar voor het ontwikkelen van chronische ontstekingen in het bronchopulmonale systeem. Dit komt door ernstige verstoringen van het lokale bronchopulmonale afweersysteem (verlaagde IgA-spiegels, interferon, fagocyterende functie van alveolaire macrofagen en leukocyten).
Alveolaire macrofagen spelen een belangrijke rol bij de ontwikkeling van chronische ontstekingen in het bronchopulmonale systeem. Ze produceren grote hoeveelheden IL-8, wat de chemotaxis van neutrofielen in de bronchiën aanzienlijk verhoogt. Neutrofielen hopen zich in grote hoeveelheden op in de bronchiën en scheiden, samen met epitheelcellen, veel pro-inflammatoire cytokinen uit, waaronder IL-1, 8, 6, tumornecrosefactor en leukotriënen.
Een belangrijke rol in de pathogenese van schade aan het bronchopulmonale systeem wordt ook gespeeld door de hoge activiteit van het enzym elastase. Er wordt onderscheid gemaakt tussen exogene en endogene elastase. De eerste wordt geproduceerd door bacteriële flora (met name Pseudomonas aeruginosa), de tweede door neutrofiele leukocyten. Elastase vernietigt het epitheel en andere structurele elementen van de bronchiën, wat bijdraagt aan verdere verstoring van het mucociliaire transport en de snelle vorming van bronchiëctasieën.
Neutrofiele leukocyten scheiden ook andere proteolytische enzymen uit. Alfa-1-antipyrsine en secretoire leukoproteasen gaan de invloed van proteolytische enzymen tegen en beschermen zo het bronchopulmonale systeem tegen hun schadelijke invloed. Helaas worden deze beschermende factoren bij patiënten met cystische fibrose echter onderdrukt door een aanzienlijke hoeveelheid neutrofiel protease.
Al deze omstandigheden dragen bij aan de introductie van een infectie in het bronchopulmonale systeem en de ontwikkeling van chronische purulente bronchitis. Bovendien moet er rekening mee worden gehouden dat het defecte eiwit, gecodeerd door het gen voor cystische fibrose, de functionele toestand van het bronchiale epitheel verandert, wat de hechting van bacteriën aan het bronchiale epitheel bevordert, met name Pseudomonas aeruginosa.
Naast de pathologie van het bronchopulmonale systeem veroorzaakt cystische fibrose ook ernstige schade aan de alvleesklier, de maag, de dikke en dunne darm en de lever.
Symptomen taaislijmziekte
Cystic fibrosis (taaislijmziekte) manifesteert zich met verschillende klinische symptomen. Bij pasgeborenen kan de ziekte zich manifesteren met meconiumileus. Door een gebrek aan, of zelfs volledige afwezigheid van, trypsine wordt meconium zeer dicht, viskeus en hoopt het zich op in de ileocaecale regio. Verder ontwikkelt zich een darmobstructie, die zich manifesteert door hevig braken met een mengsel van gal, een opgeblazen gevoel, een gebrek aan meconiumuitscheiding, het ontwikkelen van peritonitissymptomen en een snelle toename van de klinische verschijnselen van een ernstig intoxicatiesyndroom. Het kind kan in de eerste levensdagen overlijden als er geen spoedoperatie wordt uitgevoerd.
In minder ernstige gevallen is een kenmerkend teken van cystische fibrose een overvloedige, frequente ontlasting, die vettig is, veel vet bevat en een zeer onaangename geur heeft. Bij een derde van de patiënten wordt een prolaps van het rectum waargenomen.
Daarna blijven patiënten last houden van darmstoornissen, malabsorptiesyndroom, ernstige lichamelijke ontwikkelingsstoornissen en ernstige hypovitaminose.
In het eerste of tweede levensjaar treden symptomen op van schade aan het bronchopulmonale systeem (milde vorm van de ziekte), die zich manifesteren door een hoest die extreem heftig kan zijn en lijkt op een kinkhoest. De hoest gaat gepaard met cyanose, kortademigheid en het ophoesten van dik sputum, eerst slijmerig en vervolgens purulent. Geleidelijk aan ontstaat er een klinisch beeld van chronische obstructieve bronchitis en bronchiëctasieën, longemfyseem en ademhalingsfalen. Kinderen zijn extreem vatbaar voor acute virale en bacteriële infecties van de luchtwegen, wat bijdraagt aan exacerbaties en progressie van bronchopulmonale pathologie. De ontwikkeling van infectieafhankelijke bronchiale astma is mogelijk.
Bij schoolgaande kinderen kan cystische fibrose zich manifesteren als darmkoliek. Patiënten klagen over hevige, paroxysmale buikpijn, een opgeblazen gevoel en herhaaldelijk braken. Bij palpatie van de buik worden dichte formaties vastgesteld, gelegen in de uitsteeksels van de dikke darm – fecale massa's vermengd met dik, dicht slijm. Kinderen zijn zeer vatbaar voor het ontwikkelen van hypochloremische alkalose door overmatige zoutuitscheiding met zweet bij warm weer, terwijl er "zoutvorst" op de huid van het kind verschijnt.
Aandoeningen van het bronchopulmonale systeem bij volwassenen
Schade aan het bronchopulmonale systeem bij patiënten met cystische fibrose (de pulmonale vorm van de ziekte) wordt gekenmerkt door de ontwikkeling van chronische purulente obstructieve bronchitis, bronchiëctasieën, chronische pneumonie, longemfyseem, ademhalingsfalen en pulmonale hartziekte. Sommige patiënten ontwikkelen een pneumothorax en andere complicaties van cystische fibrose: atelectase, longabcessen, hemoptysis, longbloedingen en infectieafhankelijke bronchiale astma.
Patiënten klagen over een pijnlijke, paroxysmale hoest met zeer viskeus, moeilijk te scheiden mucopurulent sputum, soms met een bijmenging van bloed. Daarnaast is kortademigheid zeer kenmerkend, eerst tijdens fysieke inspanning en vervolgens in rust. Kortademigheid wordt veroorzaakt door bronchiale obstructie. Veel patiënten klagen over chronische rhinitis veroorzaakt door polyposis en sinusitis. Aanzienlijke zwakte, progressieve afname van prestaties en frequente acute respiratoire virale aandoeningen zijn ook kenmerkend. Bij onderzoek wordt de aandacht gevestigd op een bleke huid, een gezwollen gezicht, cyanose van de zichtbare slijmvliezen en ernstige kortademigheid. Bij de ontwikkeling van gedecompenseerde pulmonale hartziekte treedt oedeem op in de benen. Verdikking van de vingerkootjes in de vorm van drumsticks en nagels in de vorm van horlogeglazen kunnen worden waargenomen. De borstkas neemt een tonvormige vorm aan (als gevolg van de ontwikkeling van longemfyseem).
Percussie van de longen toont tekenen van emfyseem: een doosachtig geluid, een scherpe beperking van de beweeglijkheid van de longrand en een verlaging van de onderrand van de longen. Auscultatie van de longen toont een zware ademhaling met een verlengde uitademing, verspreide droge piepende ademhaling en vochtige, middelgrote en fijne piepende ademhaling. Bij ernstig longemfyseem is de ademhaling sterk verzwakt.
Extrapulmonale manifestaties van cystische fibrose
Extrapulmonale verschijnselen van cystische fibrose kunnen zeer uitgesproken zijn en komen vaak voor.
Schade aan de alvleesklier
Bij 85% van de patiënten met cystische fibrose wordt een insufficiëntie van de exocriene functie van de pancreas in wisselende ernst waargenomen. Bij geringe pancreasschade zijn maldigestie- en malabsorptiesyndromen afwezig; er zijn alleen laboratoriumverschijnselen van exocriene insufficiëntie (lage trypsine- en lipasewaarden in het bloed en de duodenuminhoud; vaak ernstige steatorroe). Het is bekend dat om maldigestiesyndroom te voorkomen, secretie van slechts 1 tot 2% van de totale lipase voldoende is. Alleen significante verstoringen van de exocriene functie manifesteren zich klinisch.
Onder normale omstandigheden produceren de acini van de pancreas een vloeibare secretie, rijk aan enzymen. Naarmate de secretie zich door de uitscheidingsbuis verplaatst, wordt deze verrijkt met water en anionen, waardoor deze nog vloeibaarder wordt. Bij cystische fibrose ontvangt de pancreassecretie, als gevolg van een stoornis in de structuur en functie van de transmembraanregulator (chloridekanaal), onvoldoende vloeistof, waardoor deze viskeus wordt en de bewegingssnelheid door de uitscheidingsbuis sterk afneemt. De eiwitten van de secretie zetten zich af op de wanden van kleine uitscheidingsbuizen, waardoor deze verstopt raken. Naarmate de ziekte vordert, ontwikkelen zich uiteindelijk destructie en atrofie van de acini - chronische pancreatitis met exocriene pancreasinsufficiëntie. Dit komt klinisch tot uiting in de ontwikkeling van maldigestie- en malabsorptiesyndromen. Pancreasinsufficiëntie is de belangrijkste oorzaak van vetmalabsorptie bij cystische fibrose, maar dit wordt meestal waargenomen bij een significante lipase-deficiëntie. Forsher en Durie (1991) geven aan dat bij volledige afwezigheid van pancreaslipase het vet voor 50-60% wordt afgebroken en geabsorbeerd, wat te wijten is aan de aanwezigheid van maag- en speeksellipasen (sublinguale lipase), waarvan de activiteit dicht bij de ondergrens van de norm ligt. Naast de verstoring van de vetafbraak en -absorptie, treedt er ook een verstoring op van de eiwitafbraak en -reabsorptie. Ongeveer 50% van de eiwitten die met voedsel worden opgenomen, gaat verloren met de ontlasting. De koolhydraatabsorptie wordt in mindere mate beïnvloed ondanks de deficiëntie van α-amylase, maar het koolhydraatmetabolisme kan aanzienlijk worden verstoord.
Schade aan de alvleesklier uit zich in de ontwikkeling van een slechte spijsvertering en malabsorptiesyndroom met aanzienlijk gewichtsverlies en overvloedige vette ontlasting.
De ontwikkeling van slechte spijsverterings- en absorptiesyndromen wordt ook bevorderd door ernstige disfuncties van de darmklieren, een verminderde afscheiding van darmsappen en een daling van het gehalte aan darmenzymen daarin.
Slechte spijsverterings- en malabsorptiesyndromen worden ook wel de intestinale vorm van cystische fibrose genoemd.
Een verstoorde endocriene functie van de pancreas (diabetes mellitus) wordt waargenomen bij patiënten met cystische fibrose in de late stadia van de ziekte (bij 2% van de kinderen en 15% van de volwassenen)
 [ 16 ], [ 17 ], [ 18 ], [ 19 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ]
Schade aan lever en galwegen
Bij 13% van de patiënten met gemengde en intestinale vormen van cystische fibrose ontwikkelt zich levercirrose. Dit is het meest kenmerkend voor de mutaties W128X, delta-P508 en X1303K. Biliaire levercirrose met portale hypertensie wordt bij 5-10% van de patiënten vastgesteld. Volgens Welch en Smith (1995) worden klinische, morfologische, laboratorium- en instrumentele tekenen van leverschade vastgesteld bij 86% van de patiënten met cystische fibrose.
Veel patiënten met cystische fibrose ontwikkelen ook chronische cholecystitis, vaak met stenen.
Disfunctie van de geslachtsklieren
Patiënten met cystische fibrose kunnen last hebben van azoöspermie, wat onvruchtbaarheid kan veroorzaken. Verminderde vruchtbaarheid is ook typisch voor vrouwen.
Stages
Er zijn drie gradaties in ernst van pulmonale cystische fibrose.
De milde vorm van cystische fibrose wordt gekenmerkt door zeldzame exacerbaties (niet vaker dan eenmaal per jaar); tijdens perioden van remissie zijn de klinische verschijnselen vrijwel afwezig en kunnen patiënten werken.
Matige ernst - exacerbaties worden 2-3 keer per jaar waargenomen en duren ongeveer 2 maanden of langer. In de exacerbatiefase is er sprake van hevige hoest met moeilijk op te hoesten sputum, kortademigheid, zelfs bij geringe lichamelijke inspanning, een subfebriele lichaamstemperatuur, algemene zwakte en zweten. Tegelijkertijd is er een verstoring van de exocriene functie van de pancreas. In de remissiefase is het werkvermogen niet volledig hersteld en blijft de kortademigheid tijdens lichamelijke inspanning bestaan.
Een ernstig beloop wordt gekenmerkt door zeer frequente exacerbaties van de ziekte. Remissies zijn vrijwel afwezig. In het klinische beeld treden ernstige ademhalingsinsufficiëntie en symptomen van chronische pulmonale hartziekte, vaak gedecompenseerd, en hemoptysis op de voorgrond. Er wordt aanzienlijk gewichtsverlies waargenomen en patiënten raken volledig invalide. Ernstige bronchopulmonale pathologie gaat doorgaans gepaard met een uitgesproken disfunctie van de pancreas.
Vormen
- Bronchopulmonale laesies
- Herhaalde en recidiverende longontsteking met een langdurig beloop.
- Abcesvormende longontsteking, vooral bij zuigelingen.
- Chronische longontsteking, vooral bilateraal.
- Bronchiale astma die ongevoelig is voor traditionele therapie.
- Terugkerende bronchitis, bronchiolitis, vooral met Pseudomonas aeruginosa-cultuur.
- Veranderingen in het maag-darmkanaal
- Meconium ileus en zijn equivalenten.
- Syndroom van verstoorde intestinale absorptie met onbekende oorzaak.
- Obstructieve geelzucht bij pasgeborenen met een langdurig beloop.
- Levercirrose.
- Suikerziekte.
- Gastro-oesofageale reflux.
- Galstenen.
- Rectale prolaps.
- Veranderingen in andere organen en systemen
- Groei- en ontwikkelingsstoornissen.
- Vertraagde seksuele ontwikkeling.
- Mannelijke onvruchtbaarheid.
- Neuspoliepen.
- Broers en zussen uit families met taaislijmziekte.
 [ 24 ]
[ 24 ]
Complicaties en gevolgen
Complicaties van het maag-darmkanaal zijn onder meer:
- Diabetes mellitus ontwikkelt zich bij 8-12% van de patiënten ouder dan 25 jaar.
- Fibroserende colonopathie.
- Meconiumileus in de neonatale periode (bij 12% van de pasgeborenen met cystische fibrose), distaal darmobstructiesyndroom, rectumprolaps, maagzweer en gastro-oesofageale refluxziekte.
Levercomplicaties:
- Vette leverziekte (bij 30-60% van de patiënten),
- Focale biliaire cirrose, multinodulaire biliaire cirrose en bijbehorende portale hypertensie.
Portale hypertensie leidt soms tot de dood vanwege slokdarmvarices.
Bij patiënten met cystische fibrose komen cholecystitis en galstenen vaker voor dan bij andere personen.
Vertraagde puberteit, verminderde vruchtbaarheid en andere complicaties. De meeste mannen hebben azoöspermie en een onderontwikkeling van de zaadleiders.
Diagnostics taaislijmziekte
Algemene bloedanalyse - bloedarmoede van wisselende ernst is kenmerkend, meestal normo- of hypochroom. Bloedarmoede heeft een polyfactoriële oorsprong (verminderde absorptie van ijzer en vitamine B12 in de darmen door de ontwikkeling van malabsorptiesyndroom). Leukopenie is mogelijk, met de ontwikkeling van purulente bronchitis en pneumonie - leukocytose, verhoogde bezinkingssnelheid.
Algemene urineanalyse - geen significante veranderingen, in zeldzame gevallen wordt een lichte proteïnurie waargenomen.
Coprologisch onderzoek - steatorroe en creatorroe worden waargenomen. Becker (1987) adviseert om chymotrypsine en vetzuren in de ontlasting te meten. Voordat chymotrypsine in de ontlasting wordt bepaald, is het noodzakelijk om ten minste 3 dagen voor het onderzoek te stoppen met het innemen van spijsverteringsenzymen. Bij cystische fibrose is de hoeveelheid chymotrypsine in de ontlasting verminderd en de hoeveelheid vetzuren verhoogd (de normale uitscheiding van vetzuren is minder dan 20 mmol/dag). Er moet rekening mee worden gehouden dat een verhoogde uitscheiding van vetzuren met de ontlasting ook wordt waargenomen bij:
- tekort aan geconjugeerde vetzuren in de dunne darm als gevolg van leverfalen, obstructie van de galwegen, aanzienlijke bacteriële kolonisatie van de dunne darm (in dit geval treedt intensieve hydrolyse van galzuren op);
- ileïtis;
- coeliakie (met ontwikkeling van malabsorptiesyndroom);
- enteritis;
- intestinale lymfomen;
- ziekte van Whipple;
- voedselallergieën;
- versnelde passage van voedselmassa's bij diarree van verschillende oorsprong, carcinoïdsyndroom, thyrotoxicose.
Biochemische bloedtest - verlaagde totale proteïne- en albuminegehaltes, verhoogde gehaltes van alfa2- en gammaglobulinen, bilirubine en aminotransferasen (bij leverschade), verlaagde activiteit van amylase, lipase, trypsine en ijzer- en calciumgehaltes (bij ontwikkeling van maldigestiesyndroom, malabsorptie).
Sputumanalyse - aanwezigheid van een groot aantal neutrofiele leukocyten en micro-organismen (tijdens sputumbacterioscopie).
Onderzoek naar de absorptiefunctie van de dunne darm en de exocriene functie van de pancreas brengt aanzienlijke stoornissen aan het licht.
Röntgenonderzoek van de longen toont veranderingen aan, waarvan de ernst afhangt van de ernst en de fase van de ziekte. De meest karakteristieke veranderingen zijn:
- toegenomen longpatroonvorming als gevolg van peribronchiale interstitiële veranderingen;
- uitzetting van de longwortels;
- beeld van lobulaire, subsegmentele of zelfs segmentale atelectase van de longen;
- verhoogde transparantie van de longvelden, vooral in de bovenste delen, lage positie en onvoldoende mobiliteit van het middenrif, uitbreiding van de retrosternale ruimte (manifestatie van longemfyseem);
- segmentale of polysegmentale infiltratie van longweefsel (bij de ontwikkeling van longontsteking).
Bij bronchografie worden veranderingen waargenomen die het gevolg zijn van een obstructie van de bronchiën door viskeus sputum (fragmentatie van de contrastvloeistof in de bronchiën, onregelmatige contouren, het verschijnsel van bronchiale ruptuur, een significante afname van het aantal zijtakken) en bronchoecgase (cilindrisch, gemengd), voornamelijk gelokaliseerd in de onderste delen van de longen.
Bij bronchoscopie wordt diffuse purulente bronchitis gezien met veel dik, viskeus sputum en fibrineuze films.
Spirometrie - reeds in de vroege stadia van de ziekte wordt ademhalingsfalen van het obstructieve type (verlaagde FVC, FEV1, Tiffno-index), restrictieve (verlaagde FVC) of, het vaakst, obstructief-restrictieve (verlaagde FVC, FVC, FEV1, Tiffno-index) aangetoond.
De Gibson en Cook zweettest (zweet-elektrolyttest) bestaat uit het stimuleren van zweten met behulp van pilocarpine-elektroforese, gevolgd door de bepaling van chloriden in het zweet. Doerehuk (1987) beschrijft de test als volgt. Pilocarpine-elektroforese wordt uitgevoerd op de onderarm, de elektrische stroom is 3 mA. Na reiniging van de huid met gedestilleerd water wordt het zweet verzameld met behulp van een filterpapiertje dat op het gestimuleerde gebied wordt geplaatst, bedekt met gaas om verdamping te voorkomen. Na 30-60 minuten wordt het filterpapiertje verwijderd en geëlueerd in gedestilleerd water. De hoeveelheid verzameld zweet wordt gemeten. Voor betrouwbare resultaten is het noodzakelijk om minimaal 50 mg (bij voorkeur 100 mg) zweet te verzamelen.
Als de chlorideconcentratie hoger is dan 60 mmol/l, wordt de diagnose cystische fibrose als waarschijnlijk beschouwd; als de chlorideconcentratie hoger is dan 100 mmol/l, is deze betrouwbaar; in dat geval mag het verschil in de concentratie van chloor en natrium niet groter zijn dan 8-10 mmol/l. Hadson (1983) adviseert om bij een grenswaarde van het natrium- en chloridegehalte in zweet een prednisolontest uit te voeren (5 mg oraal gedurende 2 dagen, gevolgd door bepaling van de elektrolyten in het zweet). Bij personen zonder cystische fibrose daalt het natriumgehalte in zweet tot de ondergrens van normaal; bij cystische fibrose verandert het niet. Een zweettest wordt aanbevolen voor elk kind met chronische hoest.
Analyse van bloeddruppels of DNA-monsters op belangrijke mutaties van het cystic fibrosis-gen is de meest gevoelige en specifieke diagnostische test. Deze methode is echter alleen geschikt voor landen waar de delta-P508-mutatieratio hoger is dan 80%. Bovendien is de techniek zeer duur en technisch complex.
Prenatale diagnostiek van cystische fibrose wordt uitgevoerd door de iso-enzymen van alkalische fosfatase in het vruchtwater te bepalen. Deze methode is mogelijk vanaf 18-20 weken zwangerschap.
De belangrijkste criteria voor het diagnosticeren van cystische fibrose zijn de volgende:
- aanwijzingen in de anamnese voor een vertraagde fysieke ontwikkeling in de kindertijd, terugkerende chronische luchtwegaandoeningen, dyspeptische stoornissen en diarree, de aanwezigheid van cystische fibrose bij naaste familieleden;
- chronische obstructieve bronchitis, vaak recidiverend, met de ontwikkeling van bronchiëctasieën en longemfyseem, vaak recidiverende longontsteking;
- chronische recidiverende pancreatitis met een duidelijke afname van de exocriene functie, malabsorptiesyndroom;
- verhoogd chloorgehalte in het zweet van de patiënt;
- onvruchtbaarheid met behouden seksuele functie.
Een succesvolle diagnose en differentiële diagnose van cystische fibrose wordt vergemakkelijkt door het identificeren van risicogroepen.
Cystic Fibrosis Screening Programma
- Algemeen onderzoek van bloed, urine en sputum.
- Bacteriologisch onderzoek van sputum.
- Coprologische analyse.
- Biochemisch bloedonderzoek: bepaling van totaal eiwit en eiwitfracties, glucose, bilirubine, aminotransferasen, alkalische fosfatase, gamma-glutamyltranspeptidasen, kalium, calcium, ijzer, lipase, amylase, trypsine.
- Onderzoek naar de exocriene functie van de pancreas en de absorptieve functie van de darm.
- Fluoroscopie en radiografie van de longen, CT-scan van de longen.
- ECG.
- Echocardiografie.
- Bronchoscopie en bronchografie.
- Spirometrie.
- Zweettest.
- Overleg met een geneticus.
- Analyse van bloedvlekken of DNA-monsters op belangrijke mutaties van het gen voor cystische fibrose.
Wat moeten we onderzoeken?
Hoe te onderzoeken?
Welke tests zijn nodig?
Met wie kun je contact opnemen?
Behandeling taaislijmziekte
De aard en ernst van de symptomen van cystische fibrose kunnen sterk variëren. Daarom is er geen standaardbehandelingsplan; het is individueel afgestemd op iedere patiënt.
De therapie bestaat uit de volgende therapeutische maatregelen:
- Ademhalingsoefeningen en houdingsdrainage helpen om dik slijm dat zich in de longen ophoopt, af te voeren. Sommige technieken om de luchtwegen vrij te maken vereisen hulp van familieleden, vrienden of een longarts. Veel mensen gebruiken een opblaasbaar borstvest dat op een hoge frequentie trilt.

- Inhalatiemedicijnen met een bronchusverwijdende, drainerende (mucolytische) en antibacteriële werking (bijvoorbeeld fluorchinolonen).
- Preparaten met pancreasenzymen ter verbetering van de spijsvertering. Deze preparaten worden tijdens de maaltijd ingenomen.
- Multivitaminen (inclusief vetoplosbare vitamines).
In 2015 keurde de FDA een tweede medicijn goed voor de behandeling van cystische fibrose, dat zich richt op een defect eiwit genaamd CFTR. Het eerste medicijn, een zogenaamde CFTR-modulator, werd in 2012 goedgekeurd. Verwacht wordt dat CFTR-modulatoren de levensduur van sommige mensen met cystische fibrose met tientallen jaren zullen verlengen.
Een operatie kan nodig zijn om de volgende ademhalingscomplicaties te behandelen:
- Pneumothorax, massale recidiverende of aanhoudende hemoptysis, neuspoliepen, aanhoudende en chronische sinusitis.
- Meconiumileus, intussusceptie, rectumprolaps.
Een longtransplantatie wordt uitgevoerd in het terminale stadium van de ziekte.
Prognose
De gemiddelde overlevingsleeftijd van patiënten met cystische fibrose varieert van 35 tot 40 jaar. De gemiddelde overlevingsleeftijd is hoger bij mannen dan bij vrouwen.
Met moderne behandelstrategieën bereikt 80% van de patiënten de volwassen leeftijd. Cystic Fibrosis beperkt echter de functionele mogelijkheden van de patiënt aanzienlijk. Er is nog steeds geen genezing voor deze ziekte.

