Medisch expert van het artikel
Nieuwe publicaties
Ovarieel hyperstimulatiesyndroom
Laatst beoordeeld: 05.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
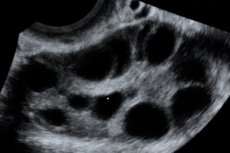
Ovarieel hyperstimulatiesyndroom (OHSS) is een iatrogene complicatie die ontstaat door de hyperergische, ongecontroleerde reactie van de eierstokken op de toediening van gonadotropinen tijdens ovulatiestimulatiecycli en programma's voor kunstmatige voortplantingstechnologie.
Het syndroom kan zich manifesteren na ovulatie-inductie met clomifeen of bij het begin van een zwangerschap in een spontane cyclus.
 [ 1 ]
[ 1 ]
Epidemiologie
De incidentie van het ovarieel hyperstimulatiesyndroom varieert van 0,5 tot 14%, afhankelijk van de ovulatiestimulatieschema's, en neemt niet af. De ziekte kent verschillende gradaties van ernst en kan fataal zijn door het ontstaan van trombo-embolische complicaties of ARDS. Het verwachte sterftecijfer is 1 op de 450.000-500.000 vrouwen. Ernstige vormen van het syndroom, waarvoor ziekenhuisopname op de intensive care vereist is, komen voor bij 0,2-10%. Volgens het Russische nationale register voor methoden voor geassisteerde voortplantingstechnologie bedroeg de incidentie van ernstig OHSS in 2004 5,6%.
Oorzaken van het ovarieel hyperstimulatiesyndroom
Risicofactoren voor het ontwikkelen van ovarieel hyperstimulatiesyndroom:
- leeftijd jonger dan 35 jaar,
- asthenische lichaamsbouw,
- de aanwezigheid van polycysteuze of multifolliculaire eierstokken,
- rijping van meer dan tien follikels in het ovulatiestimulatieprotocol,
- gebruik van gonadotropine-releasing hormone agonist-medicijnen en hoge doses gonadotropinen,
- het begin van de zwangerschap,
- ondersteuning van de luteale fase met hCG-preparaten,
- allergische ziekten.
Hoe ontstaat het ovarieel hyperstimulatiesyndroom?
Het ovarieel hyperstimulatiesyndroom treedt op tegen de achtergrond van een abnormaal hoge concentratie geslachtshormonen in het bloedplasma, met een negatieve invloed op de functies van verschillende lichaamssystemen, met name de eierstokken. Het wordt gekenmerkt door een toename van de eierstokken, soms tot 20-25 cm in diameter, met de vorming van folliculaire en luteale cysten daarin tegen een achtergrond van uitgesproken stroma-oedeem. De trigger voor de ontwikkeling van het syndroom is de introductie van een ovulatoire dosis choriongonadotrofine. De ontwikkeling van het syndroom is gebaseerd op het fenomeen van "verhoogde vasculaire permeabiliteit", wat leidt tot een massale afgifte van eiwitrijk vocht in de derde ruimte, het interstitium, en de afzetting ervan met de ontwikkeling van hypovolemie, hemoconcentratie, oligurie, hypoproteïnemie, elektrolytenonevenwichtigheid, verhoogde activiteit van leverenzymen, de vorming van ascites, hydrothorax, hydropericardium met of zonder hypovolemische shock. De "factor X" die vochttranssudatie veroorzaakt, blijft echter onbekend. In ernstige gevallen kunnen anasarca, acuut nierfalen, trombo-embolische complicaties en ARDS optreden.
Momenteel wordt het ovarieel hyperstimulatiesyndroom beschouwd vanuit het standpunt van SIRS, tegen de achtergrond waarvan massale schade aan het endotheel optreedt. Bij patiënten met OHSS werden hoge concentraties interleukinen (IL-1, IL-2, IL-6, IL-8) en tumornecrosefactoren (TNF-α, TNF-(3)) gevonden in het peritoneale transsudaat, die de synthese van prostaglandinen door de ovaria, ovariële neovascularisatie en vasculaire permeabiliteit versterken. Onder invloed van pro-inflammatoire cytokinen treedt systemische activering van stollingsprocessen op. De omvang van leukocytose correleert met de ernst van SIRS. Orgaan-systeemschade bij OHSS is vergelijkbaar met de schade die optreedt bij sepsis. De rol van de microbiële factor bij OHSS en de bijdrage ervan aan de ontwikkeling van SIRS wordt momenteel besproken. Er wordt aangenomen dat micro-organismen die zich in de darmen en het urogenitale stelsel bevinden, buiten hun leefgebied kunnen doordringen en een vergelijkbaar effect op het lichaam kunnen hebben als sepsis.
Symptomen van ovarieel hyperstimulatiesyndroom
De ernst van het syndroom hangt rechtstreeks samen met de ernst van de hemodynamische stoornissen die het klinische beeld veroorzaken. Het syndroom kan geleidelijk ontstaan met toenemende symptomen of plotseling (acuut), waarbij binnen enkele uren een sterke herverdeling van vocht in het lichaam optreedt met ophoping in de sereuze holten. Wanneer het syndroom zich manifesteert, kunnen klachten optreden zoals zwakte, duizeligheid, hoofdpijn, flikkerende "vliegjes" voor de ogen, kortademigheid in rust en bij lichamelijke inspanning, droge hoest die verergert in liggende positie, droge mond, misselijkheid, braken, diarree, een opgeblazen gevoel, een opgeblazen gevoel, spanning, buikpijn, vaak zonder duidelijke lokalisatie, zelden plassen, koorts, zwelling van de uitwendige genitaliën en onderste ledematen.
Bij patiënten met ovarieel hyperstimulatiesyndroom kan ademhalingsfalen ontstaan als gevolg van beperkte longmobiliteit door ascites, ovariumvergroting of pleurale effusie. Het beloop van ernstige OHSS in het manifestatiestadium kan gecompliceerd worden door acute hydrothorax, ARDS, longembolie, atelectase en intra-alveolaire bloeding. Pleurale effusie wordt gediagnosticeerd bij ongeveer 70% van de vrouwen met matige tot ernstige OHSS, en de effusie kan unilateraal of bilateraal zijn en treedt op tegen de achtergrond van ascites. Bij OHSS zijn verplaatsing en compressie van de mediastinale organen als gevolg van massale pleurale effusie aan de rechterkant met de ontwikkeling van shock beschreven, evenals een fatale afloop bij een vrouw met OHSS en hydrothorax als gevolg van atelectase, massale bloeding in het alveolaire lumen.
Hemodynamische stoornissen. Bij matige en ernstige OHSS treden arteriële hypotensie en tachycardie op.
Ascites. De buik is opgezwollen, vaak gespannen en pijnlijk in alle delen van de buik, maar vaker in de onderbuik ter hoogte van de uitlopers van de eierstokken.
Nier- en leverfunctiestoornissen. Urineretentie, oligurie, anurie en hepatomegalie worden waargenomen.
Het beloop van OHSS gaat bij 80% van de patiënten met een ernstige vorm van het syndroom gepaard met koorts. Bij 20% van de vrouwen treedt koorts op tegen de achtergrond van een urineweginfectie, bij 3,8% door een longontsteking en bij 3,3% door een infectie van de bovenste luchtwegen. Tromboflebitis als gevolg van het plaatsen van een intraveneuze katheter veroorzaakt bij 2% koorts en bij 1% van de patiënten ontsteking van het onderhuidse vet op de plaats van de punctie van de buikwand tijdens laparocentese. Infectie van de operatiewond treedt op bij 1% en post-injectieabcessen (intramusculaire toediening van progesteron) bij 0,5%. Koorts met een niet-infectieuze oorsprong hangt bij één op de twee patiënten met OHSS waarschijnlijk samen met endogene pyrogene mechanismen. Er zijn geïsoleerde gevallen van sepsis bij ernstige OHSS beschreven.
Tegen de achtergrond van de ontwikkeling van het syndroom treedt een verergering van latente chronische somatische ziekten op.
Wat zit je dwars?
Classificatie
Er bestaat geen eenduidige classificatie voor het ovarieel hyperstimulatiesyndroom. Op basis van klinische en laboratoriumsymptomen worden vier graden van ernst van het syndroom onderscheiden:
- Lichte OHSS. Buikklachten, eierstokken tot 8 cm in diameter met of zonder cysten, laboratoriumwaarden zijn normaal. Lichte OHSS wordt "gecontroleerde ovariële hyperstimulatie" genoemd, aangezien deze aandoening in absoluut alle cycli van superovulatiestimulatie wordt waargenomen en momenteel niet wordt beschouwd als een pathologisch syndroom dat behandeling vereist.
- Matige OHSS. Matige pijn in alle delen van de buik, misselijkheid, braken, diarree, eierstokken met een diameter van 8-12 cm met cysten, echografie en/of klinische tekenen van ascites, hematocriet niet hoger dan 45%, leukocytose - 10-16x10 9 /l, hypercoagulatie (D-dimeer - meer dan 0,5 μg/ml, fibrinogeenconcentratie - meer dan 400 mg/dl, APTT, INR - binnen de normale waarden).
- Ernstige OHSS. Hematocriet boven 45%, leukocytose 17-24x10 9 /l, hypercoagulatie (D-dimeer boven 5 μg/ml, fibrinogeen boven 600 mg/dl), ovaria groter dan 12 cm in diameter met cysten, alle klinische en laboratorium tekenen van matige OHSS en gespannen ascites, hydrothorax, leverfunctiestoornis, oligurie [diurese minder dan 0,5 ml/(kg h)].
- Kritische OHSS. Hematocriet boven 55%, leukocytose boven 25x109/l, gespannen ascites, bilaterale hydrothorax, hydropericardium, anasarca, vergrote ovaria tot 20-25 cm, oligurie of anurie, acuut nierfalen, trombo-embolische complicaties, ARDS.
Er wordt onderscheid gemaakt tussen vroeg en laat ovarieel hyperstimulatiesyndroom.
Als OHSS in de luteale fase optreedt en er geen innesteling plaatsvindt, verdwijnt het syndroom plotseling en spontaan met het begin van de menstruatie en bereikt het zelden een ernstige vorm. Als er wel innesteling plaatsvindt, wordt er meestal een verslechtering van de toestand van de patiënte waargenomen gedurende de eerste 12 weken van de zwangerschap. Late OHSS wordt veroorzaakt door een significante stijging van hCG in het bloedplasma en wordt meestal geassocieerd met innesteling en vroege zwangerschap.
Gevolgen en complicaties
Complicaties van het ovarieel hyperstimulatiesyndroom kunnen gepaard gaan met de ontwikkeling van trombo-embolische complicaties. De oorzaak van trombose bij OHSS blijft onbekend, maar de belangrijkste rol in de pathogenese van deze aandoening wordt toegeschreven aan hoge concentraties geslachtshormonen, pro-inflammatoire cytokinen, hemoconcentratie en een daling van de VCP. Lange ziekenhuisopnames, beperkte motorische activiteit, verminderde veneuze terugstroom als gevolg van een vergroting van de eierstokken, een verhoogde activiteit van stollingsfactoren, fibrinolyse-remmers en bloedplaatjes dragen extra bij aan het hoge risico op het ontwikkelen van trombotische complicaties geassocieerd met OHSS. Het is aangetoond dat bij 84% van de patiënten met trombo-embolische complicaties die ontstonden na ovulatie-inductie en in programma's voor kunstmatige voortplantingstechnologie, hun ontwikkeling plaatsvond tegen de achtergrond van de zwangerschap. In 75% van de gevallen werd trombusvorming opgemerkt in het veneuze bed, met een predominante lokalisatie in de vaten van de bovenste ledematen, nek en hoofd (60%). Bij een aantal patiënten werd spontane arteriële trombose gelokaliseerd in de cerebrale vaten vastgesteld. Minder frequent werden trombi waargenomen in de arteria femoralis, poplitea, carotis, subclavia, iliaca, ulnaris, mesenterica en de aorta. De literatuur beschrijft de ontwikkeling van occlusie van de arteria retinae centralis met visusverlies bij OHSS. De incidentie van longembolie bij patiënten met OHSS en diepe veneuze trombose van de onderste extremiteiten is 29%, terwijl bij vrouwen met OHSS en diepe veneuze trombose van de bovenste extremiteiten en arteriële trombose het risico op deze complicatie significant lager is en respectievelijk 4 en 8% bedraagt.
Ernstige gevallen van ovarieel hyperstimulatiesyndroom kunnen gepaard gaan met complicaties die een chirurgische ingreep vereisen, zoals het scheuren van een ovariumcyste en intra-abdominale bloedingen, torsie van de baarmoederaanhangsels en een buitenbaarmoederlijke zwangerschap.
Diagnose van ovarieel hyperstimulatiesyndroom
De diagnose ovarieel hyperstimulatiesyndroom wordt gesteld op basis van anamnesegegevens, een uitgebreid klinisch, laboratorium- en instrumenteel onderzoek waarbij vergrote eierstokken met meerdere cysten, een sterke hemoconcentratie en hypercoagulatie worden vastgesteld bij een patiënte die in deze cyclus gebruik heeft gemaakt van kunstmatige voortplantingstechnieken of gecontroleerde ovulatie-inductie om zwanger te worden.
Laboratoriumonderzoek
Klinische bloedtest
Hematocriet boven 40%, hemoglobineconcentratie boven 140 g/l, leukocytose tot 50x10 9 /l zonder left shift, trombocytose tot 500-600x10 6 /l. Hemoconcentratie (hematocriet boven 55%) duidt op een potentieel levensbedreigend probleem.
Biochemische bloedtest
Elektrolytenonevenwichtigheid, waaronder hyperkaliëmie (meer dan 5,3 mmol/l) en hyponatriëmie (meer dan 135 mmol/l), leidend tot een verlaagde plasma-osmolaliteit. Hypoproteïnemie (totaal eiwit meer dan 66 g/l), hypoalbuminemie (albumine minder dan 35 g/l), hoog C-reactief proteïne, verhoogde levertransaminasen tot 800 U/l, in sommige gevallen verhoogde GGT of alkalische fosfatase, bij sommige patiënten een verhoogde creatinineconcentratie van meer dan 80 μmol/l en ureum van meer dan 8,3 mmol/l.
 [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 20 ], [ 21 ], [ 22 ], [ 23 ]
Coagulogram
Verhoogde fibrinogeenspiegels boven 400 mg/dl, von Willebrandfactor boven 140%, verlaagde antitrombine III-concentraties onder 80%, D-dimeer boven 0,5 mcg/ml. Normale waarden voor APTT, PTI en INR.
 [ 24 ]
[ 24 ]
Bloedimmunoglobulinen
Verlaagde concentratie van IgG en IgA in bloedplasma. Algemene urineanalyse. Proteïnurie.
Analyse van de samenstelling van ascitesvocht
Hoog eiwitgehalte (meer dan 42 g/l) en albumine (meer dan 23 g/l), laag aantal witte bloedcellen, relatief hoog aantal rode bloedcellen, hoge concentraties van alle proinflammatoire cytokinen, C-reactief proteïne tot 135 mg/l (normaal 0-8,2 mg/l), globulinefractie van eiwitten.
 [ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
[ 25 ], [ 26 ], [ 27 ], [ 28 ], [ 29 ], [ 30 ], [ 31 ]
Tumormarkers in bloedplasma
De concentratie CA-125, die wijst op massale proliferatie van ovariumweefsel, bereikt zijn maximumwaarden (tot 5125 U/ml) in de tweede week van de OHSS-ontwikkeling, wanneer beide ovaria het meest vergroot zijn. De verhoogde waarde van de tumormarker blijft tot 15-23 weken na het optreden van tekenen van ovarieel hyperstimulatiesyndroom aanhouden, ondanks de behandeling.
Bij 50% van de patiënten is de procalcitonineconcentratie in het bloedserum vastgesteld in het bereik van 0,5-2,0 ng/ml, wat wordt beschouwd als een matige systemische ontstekingsreactie.
Microbiologisch onderzoek
Bij onderzoek van urine afkomstig uit de vagina en het baarmoederhalskanaal worden de atypische pathogenen Pseudomonas, Proteus, Klebsiella, Enterobacter en E coli geïsoleerd in hoeveelheden van meer dan 10.000 CFU/ml.
Instrumenteel onderzoek
Echografie van de bekkenorganen
Vergrote eierstokken van 6 tot 25 cm in diameter met meerdere cysten, de baarmoeder is normaal van grootte of vergroot, de aanwezigheid van vrij vocht in de bekkenholte en een normaal progressieve eenling- of meerlingzwangerschap.
Echografie van de buikorganen
De aanwezigheid van vrij vocht in de buikholte in een hoeveelheid van 1 tot 5-6 liter. Normale grootte en structuur van de lever of hepatomegalie. Echografische tekenen van galwegdyskinesie. Bij onderzoek van de nieren is het kelk-bekkencomplex onveranderd.
Echografie van de pleuraholten
Aanwezigheid van vrije vloeistof (EchoCG). Tegen de achtergrond van hemodynamische stoornissen, verminderde EF, verminderd einddiastolisch volume, verminderde veneuze terugstroom, in sommige gevallen - de aanwezigheid van vrije vloeistof in de pericardholte.
ECG
Ritmestoornissen zoals ventriculaire extrasystole, tachycardie, diffuse metabole en elektrolytveranderingen in de hartspier. Röntgenfoto van de borstkas. Wordt uitgevoerd bij verdenking op ARDS en trombo-embolie. Een karakteristieke röntgenfoto bij ARDS is het verschijnen van een "matglas" patroon en diffuse multifocale infiltraten met een vrij hoge dichtheid (consolidatie) met goed gedefinieerde luchtbronchiën, d.w.z. de ontwikkeling van uitgebreide schade aan het longparenchym. Bij longembolie onthult de röntgenfoto een hoge positie van de diafragmakoepel, discoïde atelectase, een overvloed aan één van de longwortels of een "afgesneden" wortel, depletie van het longpatroon boven het ischemische gebied van de long, en een perifere driehoekige schaduw van ontsteking.
Indicaties voor overleg met andere specialisten
Omdat alle organen en systemen bij het pathologische proces betrokken zijn, is onderzoek door een therapeut verplicht. Bij verdenking op trombotische complicaties is een consult met een vaatchirurg noodzakelijk. Bij een uitgesproken hydrothorax is een consult met een thoraxchirurg noodzakelijk om te beslissen over een pleurapunctie.
Wat moeten we onderzoeken?
Hoe te onderzoeken?
Welke tests zijn nodig?
Behandeling van ovarieel hyperstimulatiesyndroom
Het ontbreken van een duidelijk concept van de pathofysiologie van OHSS maakt het onmogelijk om een effectieve, pathogenetisch onderbouwde behandeling uit te voeren die het mogelijk maakt om de ontwikkeling van het syndroom en de multiorgaanaandoeningen die gepaard gaan met ernstige vormen van ovarieel hyperstimulatiesyndroom effectief en snel te stoppen. Momenteel bestaat er geen specifieke therapie voor ovarieel hyperstimulatiesyndroom, dus de behandelingsmaatregelen voor deze patiënten worden beperkt tot pathogene therapie totdat het syndroom spontaan verdwijnt, aangezien de hCG-concentratie in het bloedplasma gedurende 7 dagen afneemt in cycli waarin geen zwangerschap is opgetreden, of 10-20 dagen wanneer er wel zwangerschap is opgetreden. De meeste patiënten die op de intensive care worden opgenomen, worden al opgenomen met de diagnose OHSS na poliklinische behandeling, die bestaat uit dagelijkse gewichts- en diuresebeoordeling, beperking van overmatige fysieke en seksuele activiteit, overvloedig drinken met toevoeging van elektrolytrijke oplossingen en periodiek bloedonderzoek. De behandelingsstrategie voor deze groep patiënten wordt besproken en omvat een uitgebreide symptomatische behandeling die gericht is op het voorkomen van de ontwikkeling van PRF door het herstellen van de CCP, het elimineren van de hemoconcentratie, het elimineren van een elektrolytenonevenwicht en het voorkomen van acuut nierfalen, ARDS en trombo-embolische complicaties.
Fase 1 - beoordeling van de ernst van de aandoening
De eerste stap bij het bepalen van de behandelstrategie voor een patiënt met ovarieel hyperstimulatiesyndroom is het beoordelen van de hemodynamiek en de ademhalingsfunctie. Een volledig lichamelijk onderzoek met een grondige studie van de conditie van de ledematen, hoofd en hals is eveneens noodzakelijk om diepe veneuze trombose uit te sluiten en een perifere veneuze katheter of centrale veneuze katheterisatie te plaatsen. Subclavia-veneuze katheterisatie is het meest geschikt, omdat het risico op trombose in dit geval het laagst is. Blaaskatheterisatie is noodzakelijk om de diurese te beoordelen. Dagelijks moeten de klinische bloedtestparameters, bloedplasma-elektrolyten, eiwitten, leverenzymactiviteit, creatinine- en ureumwaarden en coagulogramparameters worden gecontroleerd. Een abdominale echografie wordt uitgevoerd om de mate van ovariumvergroting en de aanwezigheid van ascites te bepalen.
Fase 2 - infusietherapie
Medicamenteuze behandeling van patiënten met OHSS dient gericht te zijn op het handhaven van de hemodynamiek en het mobiliseren van vocht in de buikholte door een negatieve natrium- en waterbalans te creëren. Het primaire doel is om het volume circulerend vocht aan te vullen om de hemoconcentratie te verlagen en voldoende nierfiltratie te behouden. Kristalloïde en colloïde oplossingen worden gebruikt voor infusietherapie bij het ovarieel hyperstimulatiesyndroom.
De keuze van de kristalloïde oplossing wordt bepaald door de elektrolytenbalans. Bij het bepalen van de hoeveelheid toegediende kristalloïden moet er rekening mee worden gehouden dat bij algemene endotheelschade het volume van deze oplossingen 2-3 keer kleiner moet zijn dan het volume van colloïde oplossingen, aangezien de overheersing van kristalloïden de ophoping van vocht in de sereuze holtes verergert en in sommige gevallen leidt tot de ontwikkeling van anasarca.
Het voorkeursmedicijn voor het herstel en behoud van het intravasculaire volume bij patiënten met OHSS is hydroxyethylzetmeel 130/0 42, een dagelijks volume van 25-30 ml/kg. Hydroxyethylzetmeel 200/0 5 kan ook worden gebruikt in de basistherapie van OHSS in een volume van 20 ml/kg/dag. Het kan zich echter ophopen in het lichaam en bij langdurig gebruik leverfunctiestoornissen veroorzaken en de levertransaminasen verhogen, soms tot 800 U/l. Bij deze groep patiënten is het niet geschikt om hydroxyethylzetmeel 450/0 7 te gebruiken vanwege het hoge risico op allergische reacties, negatieve effecten op de nier- en leverfunctie en verslechtering van de hemocoagulatieparameters (verlenging van de bloedstollingstijd, risico op hemorragische complicaties). Indicaties voor het gebruik van dextranoplossingen worden beperkt door de hoge frequentie van allergische reacties, negatieve effecten op het hemostasesysteem, afgifte van von Willebrandfactor, inductie van de pro-inflammatoire cascade en het gebrek aan effect op de reologische eigenschappen van bloed in de gebruikte doses. Infusie van dextranen onder omstandigheden van verhoogde capillaire permeabiliteit kan leiden tot de ontwikkeling van het zogenaamde dextransyndroom, gepaard gaande met OL, een verminderde lever- en nierfunctie en de ontwikkeling van coagulopathie. Gelatineoplossingen zijn eveneens niet bedoeld voor infusietherapie bij OHSS.
Bij een hypoproteïnemie van minder dan 25 g/l wordt een 20% albumine-oplossing gebruikt met een dagelijks volume van 3 ml/kg. Het wordt aanbevolen om alleen een 20% albumine-oplossing te gebruiken, aangezien de oncotische druk van een 20%-oplossing ongeveer 100 mm Hg bedraagt en de oncotische druk van een 5%-oplossing ongeveer 20 mm Hg. Bij een hoge permeabiliteit van het vasculaire endotheel leidt infusie van een 5% albumine-oplossing, in tegenstelling tot een 20%-oplossing, tot een intensievere uitwisseling met de extravasculaire pool en een sterke stijging van de oncotische druk in het interstitium, wat leidt tot een toename van de interstitiële hyperhydratie van de longen.
Diuretica zijn gerechtvaardigd bij oligurie, perifeer oedeem en het bereiken van hematocrietwaarden van 36-38%. Voortijdig of overmatig voorschrijven van diuretica kan de hypovolemie en hemoconcentratie verergeren, waardoor het risico op trombotische complicaties toeneemt. Furosemide wordt voornamelijk gebruikt - 20-40 mg eenmaal intramusculair of intraveneus, langzaam toegediend gedurende 1-2 minuten.
Principes van infusietherapie bij ovarieel hyperstimulatiesyndroom
Nadat de initiële dosis kristalloïde en colloïde oplossingen is toegediend, wordt het volume van de verdere infusietherapie bepaald rekening houdend met de volgende parameters: diurese - minder dan 1 ml/(kg h), hematocriet minder dan - 40%, gemiddelde arteriële druk - meer dan 70 mm Hg, centraal veneuze druk - 8-10 mm H2O. Wanneer de gespecificeerde parameters zijn bereikt, wordt de infusietherapie gestopt. Het is raadzaam om het totale dagelijkse volume infusieoplossingen in fracties gedurende de dag toe te dienen. Het niet naleven van deze benaderingen resulteert in de ontwikkeling van hemodilutie, wat een snelle ophoping van vocht in de sereuze holtes en verslechtering van de toestand van de patiënt veroorzaakt. Een typische fout bij de behandeling van vrouwen met OHSS is de ongerechtvaardigde verlenging van de infusietherapie wanneer de hemodynamische parameters zijn genormaliseerd en een poging om de ontwikkeling van OHSS als iatrogene aandoening volledig te stoppen.
Fase 3 - preventie van complicaties
Preventie van trombose en trombo-embolie
De basis voor het voorkomen van trombotische complicaties bij het ovarieel hyperstimulatiesyndroom is het elimineren van de hemoconcentratie. Antitrombotische therapie is geïndiceerd wanneer er laboratoriumsignalen van hypercoagulatie optreden. LMWH wordt hiervoor gebruikt:
- calciumnadroparine (dagelijkse dosis - 100 anti-Xa IE/kg 2 maal subcutaan),
- dalteparinenatrium (100-150 anti-Xa IE/kg 2 maal subcutaan),
- enoxaparinenatrium (1 ml/kg/dag) 1-2 maal subcutaan).
Laboratoriummonitoring - bepaling van de plasma-anti-Xa-activiteit 3 uur na toediening van LMWH, waardoor een effectieve dosis van het geneesmiddel binnen het veilige therapeutische bereik kan worden gehandhaafd en de kans op bloedingen tot een minimum wordt beperkt. Antitrombotische geneesmiddelen worden voortgezet totdat de bloedstollingsparameters genormaliseerd zijn. Monitoring wordt uitgevoerd door de concentratie D-dimeer in plasma te bepalen met behulp van een kwantitatieve methode. De duur van de toediening van LMWH wordt individueel bepaald en kan in sommige gevallen langer zijn dan 30 dagen.
Preventie van infectieuze complicaties
Gezien het positieve effect van het voorschrijven van immunoglobulinepreparaten op het voorkomen van secundaire infecties bij andere ziekten die gepaard gaan met eiwitverlies, kan men verwachten dat deze therapie effectief zal zijn bij patiënten met OHSS. Voor de definitieve bevestiging of weerlegging van deze hypothese vanuit het oogpunt van evidence-based medicine is het echter noodzakelijk om onderzoek te doen. Momenteel is de indicatie voor empirische antibacteriële therapie het risico op secundaire infectie bij patiënten in kritieke toestand of met een instabiele hemodynamiek. Het empirisch geselecteerde geneesmiddel wordt aangepast op basis van de resultaten van bacteriologisch onderzoek. Bij het voorschrijven van empirische antibacteriële therapie is het noodzakelijk om zich te laten leiden door informatie over de ernst van de ziekte, risicofactoren voor infectie en de kenmerken van antibioticaresistentie op een bepaalde IC.
Voedingsondersteuning
Het wordt oraal toegediend aan alle patiënten met ernstige en kritieke OHSS. De volgende aanbevelingen moeten worden opgevolgd:
- energiewaarde 25-35 kcal/(kgxdag),
- glucose - minder dan 6 g/(kg x dag),
- lipiden - 0,5-1 g/(kg x dag),
- eiwitten - 1,2-2 g/(kg x dag),
- standaard dagelijkse set micro-elementen en vitaminen.
Fase 4 - chirurgische methoden
Indicaties voor laparocentese bij vrouwen met ovarieel hyperstimulatiesyndroom:
- progressieve gespannen ascites,
- oligurie minder dan 0,5 ml/dkg/min),
- een stijging van de creatinineconcentratie boven 80 μmol/l of een daling van de klaring ervan,
- hemoconcentratie met een hematocrietwaarde van meer dan 40%, die niet in aanmerking komt voor medicamenteuze correctie.
Transabdominale of transvaginale toegang kan worden gekozen voor laparocentese. Vergrote ovaria veroorzaken technische problemen, daarom is het gebruik van echografie uiterst belangrijk. Langdurige drainage van de buikholte (transabdominale laparocentese) van 14 tot 30 dagen met geportioneerde verwijdering van peritoneaal transsudaat met een apyrogene cystoFix®-katheter heeft een aantal voordelen. Zo vermijdt u de eenmalige evacuatie van een groot volume peritoneaal transsudaat en daarmee sterke schommelingen in de intra-abdominale druk die hemodynamische stoornissen veroorzaken. Daarnaast stabiliseert u de toestand van de patiënt en vermijdt u herhaalde puncties van de buikholte om ascitesvocht te verwijderen bij deze categorie patiënten. Het totale volume geëvacueerd ascitesvocht tijdens de behandeling van ernstige OHSS kan variëren van 30 tot 90 liter.
Bij patiënten met hydrothorax tegen de achtergrond van het ovarieel hyperstimulatiesyndroom is een afwachtende houding gerechtvaardigd. Bij hydrothoraxvorming wordt een pleuraholtepunctie alleen verricht bij ernstige progressieve respiratoire insufficiëntie.
Criteria voor het starten van ademhalingsondersteuning bij ernstig en kritiek ovarieel hyperstimulatiesyndroom:
- gebrek aan spontane ademhaling en pathologische ademhalingsritmes,
- afname van de ademhalingsindex tot minder dan 200 mm Hg,
- levensbedreigende hartritmestoornissen,
- aanhoudende tachycardie boven de 120,
- ernstige hypotensie,
- tachypneu boven de 40,
- betrokkenheid van de hulpademhalingsspieren.
Bij de ontwikkeling van ARDS en de overdracht naar mechanische beademing wordt het volgende toegepast:
- kleine ademhalingsvolumes (6 ml/kg),
- inspiratoire druk <30 cm H2O,
- PEEP (>10 cm H2O),
- Er wordt gebruik gemaakt van de alveolaire rekruteringsmanoeuvre.
Chirurgische behandeling van het ovarieel hyperstimulatiesyndroom is alleen gerechtvaardigd bij acute pathologie van torsie van het aanhangsel, ruptuur van de ovariumcyste of bloeding uit de ovariumcyste. Bij ovariële torsie is laparoscopische ontdraaiing van de eierstok het meest effectief. Een veelvoorkomende fout in de behandelstrategie voor patiënten met ongecompliceerde OHSS is spoedchirurgie en resectie van ongeveer 30-50% van het ovariumweefsel of bilaterale ovariëctomie.

