Medisch expert van het artikel
Nieuwe publicaties
Hypofyse-anemie (dwerggroei)
Laatst beoordeeld: 12.07.2025

Alle iLive-inhoud wordt medisch beoordeeld of gecontroleerd op feiten om zo veel mogelijk feitelijke nauwkeurigheid te waarborgen.
We hebben strikte richtlijnen voor sourcing en koppelen alleen aan gerenommeerde mediasites, academische onderzoeksinstellingen en, waar mogelijk, medisch getoetste onderzoeken. Merk op dat de nummers tussen haakjes ([1], [2], etc.) klikbare links naar deze studies zijn.
Als u van mening bent dat onze inhoud onjuist, verouderd of anderszins twijfelachtig is, selecteert u deze en drukt u op Ctrl + Enter.
Onder de term "hypofysaire dwerggroei" (van het Griekse nanos - dwerg; syn.: dwerggroei, nanosomie, microsomie) wordt in absolute zin een ziekte verstaan waarvan de belangrijkste manifestatie een sterke vertraging van de groei is, die samenhangt met een schending van de afscheiding van groeihormoon door de hypofysevoorkwab.
In bredere zin is dwerggroei een stoornis in de groei en de lichamelijke ontwikkeling, die niet alleen kan worden veroorzaakt door een absoluut of relatief tekort aan somatotroop hormoon als gevolg van een pathologie van de hypofyse zelf, maar ook door een stoornis in de regulatie van de functies van de hypothalamus (de hersenen), defecten in de biosynthese van somatotroop hormoon en stoornissen in de gevoeligheid van weefsel voor dit hormoon.
Oorzaken dwerggroei
De meeste vormen van hypofysaire dwerggroei zijn erfelijk. De meest voorkomende is panhypopituitaire dwerggroei, die voornamelijk recessief overerft. Er wordt aangenomen dat er twee soorten overdracht van deze vorm van pathologie bestaan: autosomaal en via het X-chromosoom. Bij deze vorm van dwerggroei is, naast het defect in de secretie van somatotropine, de secretie van gonadotropinen en thyreoïdstimulerend hormoon het vaakst verstoord. De secretie van ACTH is minder vaak en in mindere mate verstoord. Functionele studies met afgevende hormonen, waaronder synthetisch somatotropine-afgevende hormonen (bestaande uit 29, 40 en 44 aminozuren), vergelijkbaar met pancreaspolypeptide, hebben aangetoond dat de meeste van deze patiënten een pathologie ter hoogte van de hypothalamus hebben en dat de insufficiëntie van de hypofysevoorkwab secundair is. Primaire pathologie van de hypofyse zelf komt minder vaak voor.
Genetische dwerggroei met geïsoleerde groeihormoondeficiëntie, met een verminderde biologische activiteit en gevoeligheid ervoor, komt sporadisch voor in Rusland en aangrenzende landen. Het komt vaker voor op het Amerikaanse continent, in landen in het Nabije en Midden-Oosten en in Afrika. Op basis van de resultaten van een onderzoek naar het bloedgehalte van somatotroop hormoon en de gevoeligheid van patiënten voor exogeen somatotroop hormoon, de concentratie immunoreactieve insuline (IRI), insulineachtige groeifactoren (IGF) type I (somatomedine C) en type II, en de respons van IGF-1 op behandeling met somatotrope hormoonpreparaten, zijn verschillende varianten van klinisch vergelijkbare vormen van dwerggroei geïdentificeerd.
Onlangs is de pathogenese van Laron-dwerggroei, die wordt veroorzaakt door een tekort aan IRF-1 en IRF-II, ontrafeld. Ook is de pathogenese van dwerggroei bij Afrikaanse pygmeeën, die verband houdt met een tekort aan IRF-1, IRF-II en IRF-II, in kaart gebracht.
In 1984 werd een nieuwe variant van pseudo-hypofysaire dwerggroei beschreven met een hoog niveau van somatotroop hormoon en IGF-1. Het ontstaan van de dwerggroei wordt verklaard door een defect in de receptoren ervan, wat blijkt uit een sterke afname van de binding van huidfibroblasten aan IGF-1.
Het moet worden benadrukt dat in moderne omstandigheden, met de aanwezigheid van kleine gezinnen, veel geïsoleerde (“idiopathische”, sporadische) gevallen van de ziekte ook genetisch kunnen zijn.
Bij de analyse van 350 ziektegeschiedenissen bleek de etiologie van dwerggroei bij 228 patiënten (65,2%) onduidelijk. Deze groep omvatte patiënten uit 57 families met herhaalde gevallen van dwerggroei (2-4 gevallen per familie), wat neerkwam op 28% van alle patiënten. In 77% van de families met etiologisch onduidelijke (meestal genetische) vormen van dwerggroei werd een onmiskenbaar verband vastgesteld met de overerving van de afwezigheid van de Rh-factor. De verdeling van de Rh-factor in families van patiënten met dwerggroei verschilt van die waargenomen in het Rh-conflict tussen moeder en foetus en gaat in de regel niet gepaard met hemolytische ziekte bij de pasgeborene (de vader kan Rh-negatief zijn, en in geval van heterozygotie van de ouders voor de Rh-factor - de kinderen, enz.). Er kan een verband worden verondersteld tussen de activiteit van genen die verantwoordelijk zijn voor de synthese van somatotropine-releasing hormone (of somatotropine-releasing hormone) en genen die de Rh-factor bepalen, vooral omdat de meeste vormen van dwerggroei en de afwezigheid van de Rh-factor autosomaal recessieve kenmerken zijn. Dit verklaart echter niet de relatieve zeldzaamheid van dwerggroei in vergelijking met de frequentie van Rh-negatieve individuen in de populatie. Waarschijnlijk zijn enkele tot nu toe onbekende aanvullende factoren van belang, maar de kenmerken van de distributie van de Rh-factor in families van patiënten met familiale en sporadische dwerggroei zijn waarschijnlijk niet toevallig.
Een grote groep patiënten met dwerggroei (primair cerebraal, cerebraal-hypofyse) zijn patiënten met verschillende soorten organische aandoeningen van het centrale zenuwstelsel die in de baarmoeder of in de vroege kindertijd zijn ontstaan. De anatomische basis die deze aandoening veroorzaakt, kan een onderontwikkeling of afwezigheid van de hypofyse zijn, dystopie bij de vorming van de sella turcica, cystische degeneratie van de hypofyse, of atrofie door compressie door een tumor (craniofaryngioom, chromofoob adenoom, meningioom, glioom). Dwerggroei kan worden veroorzaakt door traumatisch letsel aan de hypothalamus-hypofyse (intra-uterien, bij de geboorte of postnataal), wat vaak voorkomt bij meerlingzwangerschappen, evenals tijdens een bevalling in stuitligging, in voetligging of in dwarsligging met rotatie op het been (dit is het mechanisme van de bevalling bij meer dan een derde van de patiënten met dwerggroei). Infectieuze en toxische schade is een belangrijke factor (intra-uteriene virale infecties, tuberculose, syfilis, malaria, toxoplasmose; ziekten op jonge leeftijd, neonatale sepsis, meningo- en arachno-encefalitis, enz.). Deze processen kunnen de hypofyse zelf en de hypothalamuscentra die de functie ervan reguleren, beschadigen en de normale functionele verbindingen in het centrale zenuwstelsel verstoren.
Intra-uteriene foetale letsels kunnen leiden tot de geboorte van patiënten met “dwerggroei vanaf de geboorte” met normale secretie van groeihormoon (cerebrale primordiale dwerggroei, microcefalie, Silver-Russell dwerggroei met lichaamshemi-asymmetrie en hoge niveaus van gonadotropinen, enz.).
Bijkomende factoren die de schending van de fysieke ontwikkeling bij dwerggroei verergeren, kunnen ontoereikende voeding zijn, een onevenwichtigheid wat betreft essentiële ingrediënten (eiwittekort) en micro-elementen (zinktekort) en ongunstige omgevingsomstandigheden, maar ook verschillende chronische ziekten, zoals glomerulonefritis, waarbij azotemie de activiteit van leverreceptoren beïnvloedt of rechtstreeks het metabolisme van levercellen beïnvloedt, wat leidt tot een afname van de synthese van somatomedine of cirrose van de lever, wanneer de vorming van somatomedine is aangetast.
Pathogenese
Bij de meeste patiënten met hypofysaire dwerggroei blijven de veranderingen niet beperkt tot een pathologie van de secretie van somatotroop hormoon en de gevoeligheid daarvoor, maar strekken ze zich uit tot andere tropische hormonen van de hypofyse, wat verschillende combinaties van endocriene en stofwisselingsstoornissen veroorzaakt.
Bij een geïsoleerde deficiëntie van somatotroop hormoon zijn morfologische veranderingen in de hypofyse nog nauwelijks onderzocht. In de bestudeerde gevallen werden zelden pathologische afwijkingen gevonden (craniofaryngioom of hyperostose van de schedelbeenderen). Bij dit type dwerggroei kan een aangeboren onderontwikkeling van peptiderge cellen of een defect in het neurotransmittersysteem in de hypothalamus worden waargenomen. In dergelijke gevallen kan dwerggroei gepaard gaan met dysplasie of hypoplasie van de oogzenuwen. Intraselaire cysten, hypofysetumoren en hypothalamustumoren leiden tot een STH-deficiëntie, wat leidt tot compressie van het hypofyseweefsel, met name somatotrofen.
Dwerggroei wordt gekenmerkt door verdunning van de botten, voornamelijk veroorzaakt door de corticale laag, vertraagde differentiatie en ossificatie van het skelet. De inwendige organen zijn hypoplastisch, soms atrofisch, en de spieren zijn slecht ontwikkeld.
Symptomen dwerggroei
Een sterke groeiachterstand en fysieke ontwikkeling zijn de belangrijkste verschijnselen van hypofysaire dwerggroei. Patiënten worden geboren met een normaal lichaamsgewicht en een normale lengte en beginnen vanaf de leeftijd van 2-4 jaar een groeiachterstand te vertonen.
Vóór de komst van een actieve behandeling voor nanisme werden dwergen beschouwd als personen met een lengte van minder dan 120 cm voor vrouwen en 130 cm voor mannen. Tegenwoordig wijkt de lengte van een dwerg minstens 2-3 sigma af van de gemiddelde tabelnorm voor een bepaald geslacht, leeftijd of populatie. Er bestaat ook een methode voor het grafisch beoordelen van de lengte op basis van de Gaussische verdelingscurve. In dit geval worden dwergen op basis van lengte opgenomen in een groep die het minimale aantal individuen in de corresponderende populatie bevat met de grootste achterstand ten opzichte van de gemiddelde groeinorm.
Hypofysaire dwerggroei wordt niet alleen gekenmerkt door een kleine absolute lichaamsgrootte, maar ook door een geringe jaarlijkse groei en fysieke ontwikkelingsdynamiek. De lichaamsbouw is proportioneel, maar de lichaamsproporties van patiënten zijn typisch voor de kindertijd. De huid is bleek, vaak met een gelige tint, droog, wat te wijten is aan absolute of relatieve schildklierinsufficiëntie; soms wordt cyanose - "marmering" van de huid - waargenomen. Bij onbehandelde patiënten treedt al vroeg een verouderde en gerimpelde huid (gerodermie) op. Dit komt door de onvoldoende anabole werking van STH en de langzame verandering van cellulaire generaties.
Het haar op het hoofd kan normaal of droog, dun en broos zijn; lange wimpers zijn typisch. Secundaire haargroei is vaak afwezig. De grootte van de sella turcica is bij de meeste patiënten met dwerggroei (70-75%) niet veranderd, maar de sella behoudt vaak de kinderlijke vorm van een "staande ovaal", heeft een brede "juveniele" rug en de sinus van het wiggenbeen blijft achter qua pneumatisering. Er zijn echter patiënten met een vergrote sella turcica, wat een teken is van een tumor; met verkalkte plekken op de achtergrond of in het ingangsgebied (met craniofaryngioom, restverschijnselen van neuro-infectie) of met afname (tekenen van onderontwikkeling, kleine omvang van de hypofyse). Symptomen van intracraniële hypertensie worden waargenomen: verdunning van de schedelbotten, een toegenomen vaatpatroon, aanwezigheid van vingerafdrukken, enz. Het belangrijkste teken van hypofysaire dwerggroei is een vertraging in de timing van differentiatie en ossificatie van het skelet. Ook kenmerken van het gebit hangen nauw samen met skeletdifferentiatie: late vervanging van melktanden wordt opgemerkt. De grootste vertraging in de ontwikkeling van het skelet wordt waargenomen bij patiënten met dwerggroei met seksuele insufficiëntie en hypothyreoïdie.
De genitaliën van de meeste patiënten zijn ernstig onderontwikkeld, hoewel misvormingen zeldzaam zijn. We zagen cryptorchisme bij 5,8% van de mannelijke patiënten. Seksuele insufficiëntie gaat gepaard met een onderontwikkeling van de secundaire geslachtskenmerken en een verminderd seksueel verlangen, waarbij de menstruatie uitblijft. Een normale spontane seksuele ontwikkeling wordt alleen waargenomen bij patiënten met een geïsoleerde groeihormoondeficiëntie en bij sommige patiënten met cerebrale dwerggroei.
Schildklierinsufficiëntie is een vrij veelvoorkomend symptoom van dwerggroei. Opgemerkt dient te worden dat de uiterlijke manifestaties van hypothyreoïdie niet altijd de werkelijke functionele toestand van de schildklier weerspiegelen. Dit komt door relatieve hypothyreoïdie als gevolg van een verstoring van de overgang van thyroxine (T 4 ) naar trijodothyronine (T 3 ) en de vorming van inactief (reversibel) T 3, wat kenmerkend is voor somatotrope insufficiëntie.
De adrenocorticotrope functie bij hypofysaire dwerggroei neemt minder vaak en in mindere mate af dan de geslachts- en schildklierstimulerende functies, en vereist bij de meeste patiënten geen speciale correctie.
In de meeste gevallen is er geen sprake van een aantasting van het intellect. Emotionele veranderingen in de vorm van mentaal infantilisme komen voor; bij oudere patiënten zonder verstandelijke beperking worden soms reactieve neurosen waargenomen.
Bij organische cerebrale pathologie, met name van tumorachtige aard, kan dwerggroei optreden met symptomen van diabetes insipidus, bitemporale hemianopsie en verstandelijke beperkingen.
Onderzoek naar de ontwikkeling van de bio-elektrische activiteit van de hersenen bij patiënten zonder organische symptomen van het centrale zenuwstelsel toonde aan dat hun EEG gekenmerkt wordt door kenmerken van onvolwassenheid, langdurig behoud van een hoge "kinderlijke" EEG-spanning; onregelmatigheid van het alfaritme in amplitude en frequentie; een sterke toename van de hoeveelheid langzame θ- en δ-ritmes, met name in de frontale en centrale afleidingen; een duidelijke reactie op hyperventilatie; een verschuiving van het bereik van EEG-ritmes naar lage frequenties, volgend op de ritmes van lichtstimulatie (bewijs van een afname van de functionele mobiliteit van de zenuwstructuren van de hersenen). Bij oudere patiënten bleek de onvolwassenheid van de elektrische activiteit van de hersenen te wijten te zijn aan seksuele onderontwikkeling, en bij patiënten van alle leeftijdsgroepen aan hypothyreoïdie.
Het koolhydraatmetabolisme bij patiënten met dwerggroei wordt gekenmerkt door een neiging tot verlaging van de nuchtere bloedglucosespiegel, een toename tijdens fysieke inspanning, een tekort aan endogene insuline en een verhoogde gevoeligheid voor exogene insuline met frequente ontwikkeling van hypoglykemie. Dit laatste wordt voornamelijk verklaard door een tekort aan contra-insulaire hormonen in het lichaam van de patiënt.
Inwendige organen vertonen splanchnomycrie, d.w.z. een afname in hun omvang. Er zijn geen functionele veranderingen in inwendige organen beschreven die specifiek zijn voor dwerggroei. Arteriële hypotensie met een verlaagde systolische en diastolische druk en een verminderde polsamplitude wordt vaak waargenomen. Harttonen zijn gedempt, functionele ruisen van verschillende aard worden gehoord als gevolg van trofische veranderingen in de hartspier en autonome stoornissen. Het ECG wordt gekenmerkt door een lage spanning (vooral bij hypothyreoïdie), sinusbradycardie of bradyaritmie; PCG toont een afname in de amplitude van tonen, extra tonen en functionele ruisen. Oxygemometriegegevens duiden op hypoxemie (initieel en tijdens fysieke inspanning) en zuurstoftekort. Oudere patiënten ontwikkelen soms hypertensie.
Diagnostics dwerggroei
De diagnose en differentiële diagnose van dwerggroei zijn gebaseerd op anamnesegegevens en een uitgebreid klinisch, radiologisch, laboratorium- en hormonaal onderzoek. Om de groei van patiënten te beoordelen, wordt naast de absolute lichaamsgrootte ook de groeiachterstand bepaald: het verschil tussen de lengte van de patiënt en zijn gemiddelde norm voor het betreffende geslacht en de bijbehorende leeftijd; de groeileeftijd: de mate waarin de lengte van de patiënt voldoet aan bepaalde normen; en de indicator voor genormaliseerde afwijkingen.
I = M - Mcp / δ, waarbij M de lengte van de patiënt is, Mcp de gemiddelde normale lengte voor een bepaald geslacht en een bepaalde leeftijd, en δ de kwadratische afwijking van Mcp; I kleiner dan 3 is typisch voor nanisme, I groter dan 3 is typisch voor gigantisme. Deze indicator kan worden gebruikt om de ontwikkelingsdynamiek te beoordelen.
Röntgenonderzoek bij patiënten met dwerggroei toont tekenen van intracraniële hypertensie, restverschijnselen van neuro-infectie, verkalkingen en craniosynostose. De studie van de grootte, vorm en structuur van de sella turcica wordt beschouwd als een indirecte indicator die de grootte van de hypofyse karakteriseert. Een van de belangrijkste manifestaties van pathologische groeiachterstand is een verstoring van de skeletdifferentiatie. Om de mate van skeletrijpheid te beoordelen, wordt de (radiografische) botleeftijd bepaald, die overeenkomt met de botweefseldifferentiatie; ossificatiedeficiëntie is de mate van ossificatieachterstand ten opzichte van de norm (in jaren); de ossificatiecoëfficiënt is het quotiënt van de botleeftijd gedeeld door chronologische en andere parameters.
Moderne diagnostiek van dwerggroei is onmogelijk zonder onderzoek naar de secretie van somatotroop hormoon, het basale niveau, het circadiane ritme en de afgifte onder stimulatie. De meeste patiënten met hypofysaire dwerggroei worden gekenmerkt door een verlaagd gehalte aan somatotroop hormoon in het bloedserum. Wanneer bepaald met de radioimmunologische methode, ligt dit (volgens verschillende auteurs) tussen (0,87±0,09) en (1,50±0,64) ng/ml, met een gemiddelde norm van (3,81±0,29) ng/ml. Een onderzoek naar dagelijkse (circadiaanse) ritmes van de somatotrope hormoonsecretie toonde aan dat het niveau bij gezonde mensen maximaal is tijdens de eerste 2 uur van de slaap en tussen 4 en 6 uur 's ochtends. Bij dwerggroei is het gehalte aan somatotroop hormoon ook tijdens deze uren verlaagd.
Om de reserves van de somatotrope functie te onderzoeken, worden verschillende stimulerende middelen gebruikt, waarbij het gehalte aan somatotroop hormoon vóór en na toediening wordt onderzocht. Bloed voor het onderzoek wordt gedurende 2-3 uur elke 30 minuten afgenomen. De afgifte van somatotroop hormoon na stimulatie wordt als normaal beschouwd tot ten minste 7-10 ng/ml, soms zelfs 20-40 ng/ml. Indien er in één van de monsters geen reactie optreedt, worden de tests herhaald met andere stimulerende middelen. Een tekort aan somatotroop hormoon wordt als bewezen beschouwd indien er in 2-3 verschillende monsters geen afgifte van somatotroop hormoon plaatsvindt.
De meest gebruikte stimulerende tests zijn: bij intraveneuze toediening van 0,1 E (0,75-1,5 E) insuline per 1 kg lichaamsgewicht van de patiënt en het bereiken van hypoglykemie (een daling van de bloedglucosespiegel met 50% ten opzichte van de beginwaarde), wordt het serumsomatotroop hormoon bepaald volgens bovenstaand schema. Indien ernstige hypoglykemie ontstaat, wordt de test onderbroken en krijgt de patiënt intraveneus glucose toegediend. Dit is de meest gebruikelijke, klassieke diagnostische methode.
TRH in een dosis van 200-500 mcg intraveneus. Identificeert effectief hormoonreserves en veroorzaakt geen complicaties. In combinatie met de insulinetest kan de mate van schade aan het hypothalamus-hypofysesysteem worden beoordeeld. Een positieve reactie op TRH bij afwezigheid van insulinehypoglykemie wijst op de intactheid van de hypofyse en schade op hypothalamusniveau. Negatieve reacties op TRH en hypoglykemie wijzen op schade aan de hypofyse zelf.
TRH, LH-RH in een dosis van 300 mcg intraveneus is vergelijkbaar met de vorige.
Menselijk SGH is een synthetisch analoog van een biologisch actieve verbinding, geïsoleerd uit een pancreastumor. Momenteel bestaan er drie soorten synthetisch SGH: met 29, 40 en 44 aminozuren. Het wordt intraveneus toegediend in doses van 1 tot 3 μg/kg lichaamsgewicht van de patiënt. De afgifte van STH wordt 15-20 minuten na toediening waargenomen; de test is effectiever dan andere in het aantonen van reserves van endogeen groeihormoon. Een positieve SGH-reactie duidt op een hypothalamische beschadiging van de somatotrope functie en een intacte hypofyse; met aminozuren (L-arginine monochloride, ornithine, tryptofaan, glycine, leucine) intraveneus toegediend in een dosis van 0,25-0,5 g per 1 kg lichaamsgewicht van de patiënt. Effectief voor het bestuderen van SGH-reserves. Kan allergische reacties veroorzaken.
L-dopa oraal in een dosis van 250-500 mcg. Effectief en goed verdragen door patiënten.
Ook worden testen met glucagon, broom-ergocryptine (Parlodel), lysine-vasopressine, clonidine en gedoseerde fiets-ergometrische belasting gebruikt.
Het bestuderen van de toestand van de somatotrope functie is niet alleen noodzakelijk voor de diagnose van dwerggroei, maar ook voor de verantwoorde keuze van een therapiemethode, aangezien behandeling met somatotropine alleen rationeel is in geval van een tekort aan endogeen groeihormoon.
Voor de diagnose van dwerggroei is het zeer belangrijk om het gehalte aan insulineachtige groeifactoren, oftewel somatomedines (met name IGF-1 of somatomedine C), te bestuderen – mediatoren van de werking van somatotroop hormoon op weefselniveau. Het is bekend dat het gehalte aan somatomedine C bij dwerggroei verlaagd en bij acromegalie verhoogd is ten opzichte van de norm. De door Laron beschreven vorm van dwerggroei is een ziektebeeld met een normale productie van STH, maar met een verstoring van de vorming van IGF-1 en IGF-II. Behandeling van dergelijke patiënten met somatotropine is zinloos.
Indirecte indicatoren van de somatotrope functie van de hypofyse zijn de activiteit van alkalische fosfatase en het gehalte aan anorganisch fosfor in het serum. Bij hyposomatotrope aandoeningen zijn deze indicatoren verminderd. Bij de panhypopituitaire vorm van dwerggroei is de secretie van gonadotropinen, vaak TSH, verminderd, wat gepaard gaat met een overeenkomstige afname van de functies van de geslachtsklieren (tekort aan androgenen of oestrogenen), de schildklier (een afname van de niveaus van T3 , T4 , eiwitgebonden jodium - PBI, accumulatie van 131 I door de schildklier) en de bijnieren (een afname van de hoeveelheid cortisol en 17-OCS in het plasma, uitscheiding van 17-KC en 17-OCS in de urine, lymfocytose).
Alle vormen van genetische dwerggroei van de hypofyse (hypothalamisch-hypofyse) worden gekenmerkt door herhaalde ziekte bij kinderen in een familie met overerving door autosomaal recessief (vaker) of autosomaal dominant type, groeiachterstand en fysieke ontwikkeling vanaf 2-4 jaar met een achterstand van ten minste 2-3 graden ten opzichte van de gemiddelde groeinormen voor een bepaald geslacht, leeftijd en bevolkingsgroep, met een lage spontane jaarlijkse groeidynamiek en vertraagde ossificatie. Bij een lage somatotrope hormoonspiegel (in 2-3 stimulerende tests lager dan 7 ng/ml) is therapie met somatotrope hormoon zeer effectief (geeft een lengtetoename van ten minste 7 cm per jaar). Bij een normale of hoge somatotrope hormoonspiegel (met zijn biologische inactiviteit) kan de gevoeligheid voor het hormoon behouden blijven. Er worden geen veranderingen in intelligentie waargenomen.
Bij genetische dwerggroei met weefselongevoeligheid voor somatotropine is het klinische beeld vergelijkbaar met dat van een geïsoleerde groeihormoondeficiëntie, maar is somatotropinetherapie niet effectief. In deze groep worden de volgende hoofdvormen onderscheiden, afhankelijk van het IRF-niveau: met een normale inhoud (IRF-receptordefect) en gereduceerde - Laron-dwerggroei (IRF-1- en IRF-II-deficiëntie) en het type dat voorkomt bij Afrikaanse pygmeeën (IRF-1-deficiëntie).
Cerebrale dwerggroei wordt gekenmerkt door geïsoleerde aandoeningen in een familie die gepaard gaan met intra-uteriene of postnatale schade aan het centrale zenuwstelsel, met de aanwezigheid van duidelijke organische veranderingen in het centrale zenuwstelsel, vaak gecombineerd met een pathologie van het visuele orgaan, de aanwezigheid van diabetes insipidus, het behoud van gonadotrope functies en veranderingen in intelligentie.
Sommige vormen van gonadale dysgenesie en agenesie gaan gepaard met een opvallende kleine gestalte, met name het Shereshevsky-Turnersyndroom en de "Turneroïde" (mozaïek)vorm van testiculaire dysgenesie. Cytogenetisch onderzoek (geslachtschromatine, karyotypering) helpt bij de differentiële diagnose en toont chromosomale afwijkingen aan, evenals karakteristieke afwijkingen in de somatische en seksuele ontwikkeling, normale of verhoogde waarden van endogeen somatotroop hormoon en ongevoeligheid voor behandeling met somatotropine.
Onder de endocriene aandoeningen die gepaard gaan met een kleine lichaamslengte, dient primaire hypothyreoïdie te worden onderscheiden. Deze aandoening wordt veroorzaakt door congenitale hypoplasie of aplasie van de schildklier, dystopie, enzymatische defecten in de biosynthese van schildklierhormonen en vroege auto-immuunschade aan de schildklier. Bij al deze aandoeningen overheersen tekenen van hypothyreoïdie met een hoge TSH-spiegel en een daling van T4 en T3 in het bloedserum . Bij myxoedeem met auto-immuungenese worden antilichamen tegen thyreoglobuline, microsomale en nucleaire fracties van schildklierweefsel in het bloed aangetroffen en is de spiegel van somatotroop hormoon normaal of verlaagd. Het klinische effect kan worden bereikt door hypothyreoïdie alleen te compenseren.
Een kleine gestalte gaat gepaard met een vroegtijdige seksuele ontwikkeling en een adrenogenitaal syndroom als gevolg van een vroegtijdige sluiting van de groeizones; de ziekte van Itsenko-Cushing, die in de kindertijd ontstaat door de remmende werking van glucocorticoïden op de secretie van somatotroop hormoon en hun katabole werking; het syndroom van Mauriac - een kleine gestalte en infantilisme bij patiënten met ernstige insuline-afhankelijke diabetes mellitus.
Hypofysaire dwerggroei moet worden onderscheiden van somatogene vertraging in de fysieke ontwikkeling die wordt veroorzaakt door chronische stofwisselingsstoornissen (bij ziekten van de lever, nieren, het maag-darmkanaal), chronische hypoxie (bij ziekten van het cardiovasculaire en ademhalingsstelsel, bij bloedarmoede); door systemische ziekten van het bewegingsapparaat (chondrodystrofie, imperfecte osteogenese, exostose), enz.
Functionele (constitutionele) groeivertraging wordt soms waargenomen bij laat in de puberteit bij ogenschijnlijk gezonde adolescenten; we hebben vastgesteld dat dit voornamelijk verband houdt met een voorbijgaande insufficiëntie van gonadotrope activiteit. De secretie van somatotroop hormoon is meestal niet verstoord of licht verminderd. Stimulatie van gonadotropinen kan zowel de seksuele ontwikkeling als de groei versnellen.
Een kleine lichaamslengte die verband houdt met het gezinsleven, moet worden beschouwd als een variant van de fysiologische ontwikkeling.
Wat moeten we onderzoeken?
Hoe te onderzoeken?
Welke tests zijn nodig?
Met wie kun je contact opnemen?
Behandeling dwerggroei
De behandeling van dwerggroei is een langdurig proces. Dit dwingt de arts om de middelen om de groei te beïnvloeden over de tijd te verdelen om het beste klinische effect te bereiken, waarbij twee basisprincipes in acht moeten worden genomen:
- maximale benadering van de door de behandeling geïnduceerde ontwikkeling met de fysiologische omstandigheden;
- de epifysaire groeizones worden gespaard.
Jarenlange ervaring in de behandeling van dwerggroei stelt ons in staat om het volgende schema van gefaseerde therapie als passend te beschouwen. De diagnose dwerggroei bij volwassen patiënten roept doorgaans geen twijfels op. Bij jonge kinderen is, indien het klinische beeld onduidelijk is, een diagnostische periode noodzakelijk: 6-12 maanden onder observatie zonder hormoontherapie. Gedurende deze tijd wordt een complexe, algemene versterkende behandeling voorgeschreven; adequate voeding met een verhoging van het gehalte aan dierlijke eiwitten, groenten en fruit in de voeding, vitamine A en D, calcium- en fosforpreparaten. Het ontbreken van voldoende veranderingen in groei en fysieke ontwikkeling tegen deze achtergrond en het opsporen van endocriene stoornissen tijdens onderzoek vormen de basis voor het starten van hormoontherapie.
De belangrijkste vorm van pathogenetische therapie voor hypofysaire dwerggroei is het gebruik van humaan groeihormoon, aangezien het optreden van de meeste gevallen van dwerggroei ongetwijfeld afhankelijk is van een of andere vorm van deficiëntie. Vanwege de soortspecificiteit van dit hormoon is alleen humaan en primaten somatotropine actief bij mensen. Een geneesmiddel geïsoleerd uit de hypofyse van mensen die zijn overleden aan niet-infectieuze en niet-neoplastische ziekten wordt veel gebruikt in de kliniek. Humaan somatotropine wordt verkregen door bacteriële synthese met behulp van Escherichia coli door middel van genetische manipulatie. Humaan somatotropine wordt ook chemisch gesynthetiseerd, maar het is extreem duur en wordt praktisch niet gebruikt in de kliniek. Patiënten met een bewezen deficiëntie van endogeen groeihormoon, met een skeletdifferentiatie die het typische niveau van 13-14 jaar niet overschrijdt, worden geselecteerd voor somatotropinebehandeling. Er zijn geen leeftijdsbeperkingen voor de behandeling.
De minimale effectieve doses die in de eerste behandelperiode kunnen worden gebruikt, zijn 0,03-0,06 mg/kg lichaamsgewicht. De meest effectieve doses zijn 2-4 mg driemaal per week. Verhoging van de eenmalige dosis tot 10 mg leidde niet tot een voldoende toename van het groei-effect, maar veroorzaakte een snelle vorming van antistoffen tegen somatotropine.
In ons land wordt sinds 1960 onderzoek gedaan naar het effect van menselijk groeihormoon. Er zijn twee behandelregimes getest: continu en intermitterend, met kuren van 2-3 maanden en gelijke tussenpozen. De gemiddelde lengtetoename van patiënten gedurende het eerste jaar van de behandeling was 9,52 ± 0,39 cm, de toename van het lichaamsgewicht was 4,4 ± 0,14 kg. Bij langdurige continue behandeling was de gemiddelde lengtetoename 0,82 cm/maand, het lichaamsgewicht - 0,38 kg/maand; bij intermitterende behandeling - respectievelijk 0,75 cm/maand en 0,4 kg/maand. Continue behandeling zorgde voor een snellere lengtetoename met een scherpe afname van het effect na 1-1,5 jaar, bij intermitterende behandeling bleef de effectiviteit 3-4 jaar behouden, waardoor we het behandelregime geschikter kunnen achten. Bepaling van de IGF-I-spiegel (somatomedine C) kan dienen als een betrouwbare indicator voor de gevoeligheid van de patiënt voor behandeling met somatotropine. Een verhoging van de IGF-I-spiegel na toediening van somatotropine maakt het mogelijk om een positief effect van de therapie te voorspellen. Een belangrijk voordeel van behandeling met somatotropine is de afwezigheid van versnelling van de skeletossificatie tegen de achtergrond van de behandeling.
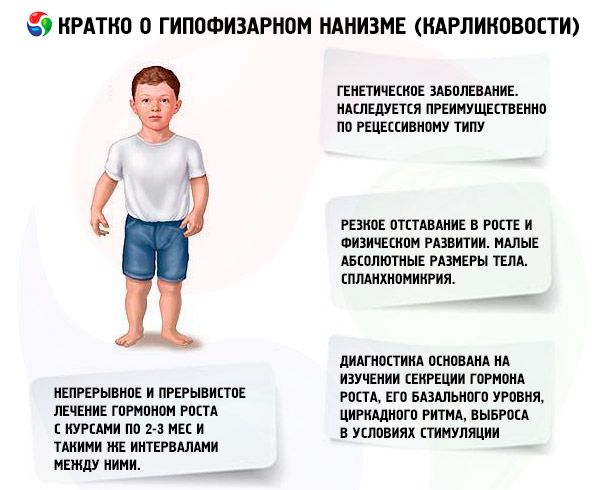
De belangrijkste behandeling van dwerggroei is het gebruik van anabole steroïden, die de groei stimuleren door de eiwitsynthese te verbeteren en de spiegel van endogeen somatotroop hormoon te verhogen. De behandeling duurt meerdere jaren, waarbij sommige medicijnen geleidelijk worden vervangen door andere, van minder werkzame naar meer werkzame stoffen. Een overstap naar anabole medicijnen is geïndiceerd wanneer het groei-effect na 2-3 jaar afneemt, wat leidt tot een extra toename van de groei. De behandeling wordt in kuren uitgevoerd (de rustperiode moet de helft van de behandelperiode zijn). Bij verslaving zijn ook langere pauzes geïndiceerd (tot 4-6 maanden). Slechts één van de anabole steroïden wordt tegelijk voorgeschreven. Het combineren van 2 of meer medicijnen is niet geschikt, omdat dit hun metabole en groei-effecten niet versterkt. Dit laatste hangt voornamelijk af van de leeftijd van de patiënt en de mate van differentiatie van de skeletbotten aan het begin van de behandeling. Het beste effect wordt waargenomen bij patiënten jonger dan 16-18 jaar met een skeletale ossificatie die het niveau van een 14-jarige niet overschrijdt. Het is raadzaam om direct na de diagnose met de behandeling te beginnen, meestal vanaf de leeftijd van 5-7 jaar. Vóór de behandeling is het noodzakelijk om het voorschrijven van gonadotropinen en geslachtshormonen te vermijden, aangezien deze, terwijl ze de groei stimuleren, tegelijkertijd de skeletdifferentiatie versnellen. Het principe van het doseren van anabole steroïden is van de minimaal effectieve dosis naar geleidelijke verhoging ervan. De aanbevolen doseringen van de meest voorkomende geneesmiddelen: nerobol (methandrostenol, dianabol) - 0,1-0,15 mg per 1 kg lichaamsgewicht per dag oraal; nerobolil (durabolin) - 1 mg per 1 kg lichaamsgewicht per maand intramusculair; de maandelijkse dosis wordt toegediend in 2-3 doses, respectievelijk na 15 of 10 dagen; retabolil (deca-durabolin) - 1 mg per 1 kg lichaamsgewicht eenmaal per maand intramusculair. Overschrijding van de aangegeven dosering kan leiden tot androgenisatie. In fysiologische doses hebben deze verbindingen geen significante invloed op de conditie van de genitaliën en de differentiatie van skeletbotten, waardoor ze langdurig gebruikt kunnen worden bij patiënten van beide geslachten. Meisjes dienen onder toezicht te staan van een gynaecoloog, aangezien bij overdosering of verhoogde individuele gevoeligheid sommige patiënten tekenen van virilisatie kunnen ontwikkelen, die snel afnemen wanneer de behandeling wordt stopgezet. Orale geneesmiddelen die gemethyleerd tot geëthyleerd zijn op de 17e positie kunnen soms een cholestatisch effect veroorzaken; daarom is bij leveraandoeningen de voorkeur te geven aan parenterale anabole verbindingen, of moeten orale geneesmiddelen gecombineerd worden met choleretische middelen. Zeer zelden kan behandeling met anabole steroïden allergische reacties veroorzaken (jeuk, huiduitslag). Bij afwezigheid van complicaties worden anabole steroïden gebruikt zolang het groei-effect zichtbaar is (tot 16-18 jaar, en soms langer). De behandeling wordt uitgevoerd tegen de achtergrond van algemene versterkingstherapie.
Indien patiënten tekenen van hypothyreoïdie vertonen, worden gelijktijdig schildkliermedicijnen (thyroxine, thyroidine, thyrotom) voorgeschreven in individueel gekozen doses.
Bij de behandeling van jongens is de volgende stap de toediening van humaan choriongonadotrofine. Dit medicijn wordt niet eerder dan op 15-16-jarige leeftijd gebruikt, en vaak zelfs op een nog latere leeftijd, om de Leydigcellen te stimuleren, wat zowel de seksuele ontwikkeling als de groei versnelt (dankzij de anabole activiteit van hun eigen androgenen). Doses van 1000 tot 1500 IE worden 1-2 keer per week intramusculair toegediend in kuren van twee maanden, maximaal 2-3 keer per jaar. Bij onvoldoende effect wordt de behandeling met humaan choriongonadotrofine bij jongens van 16 jaar en ouder afgewisseld met toediening van lage doses androgenen (methyltestosteron in een dosis van 5-10 mg/dag sublinguaal).
Meisjes ouder dan 16 jaar kunnen beginnen met de behandeling met lage doses oestrogenen, die een normale seksuele cyclus simuleren. De behandeling duurt drie weken per maand, gevolgd door een pauze. In de tweede fase van de cyclus, vanaf de derde week, kan choriongonadotrofine worden voorgeschreven in een dosis van 1000-1500 IE, drie tot vijf keer per week, of geneesmiddelen met een gestageen effect (pregnine, progesteron).
De laatste fase van de behandeling (na het sluiten van de groeizones) bestaat uit de constante toediening van therapeutische doses geslachtshormonen die overeenkomen met het geslacht van de patiënt, om de genitaliën en secundaire geslachtskenmerken volledig te ontwikkelen en het libido en de potentie te garanderen. Gecombineerde oestrogeen-progestageenpreparaten (non-ovlon, bisecurine, infekundine, rigevidon) zijn geschikt voor de behandeling van vrouwelijke patiënten, en preparaten met verlengde afgifte van androgeen (testenaat, sustanon-250, omnadren-250) zijn geschikt voor de behandeling van mannelijke patiënten.
Er wordt een algemene versterkende behandeling uitgevoerd (regime, eiwitrijk plantaardig dieet, vitaminetherapie, biostimulantia). Het gebruik van zinkpreparaten is geïndiceerd, waarvan het werkingsmechanisme voornamelijk bestaat uit het verhogen van de activiteit van IGF-1 (insuline-achtige groeifactor I).
Bij organische pathologie van het centrale zenuwstelsel worden ontstekingsremmende, resorptieve en dehydratatietherapie toegepast. Gerichte systematische therapie heeft een bemoedigend effect. Dankzij een langdurige, gefaseerde behandeling bereikten 148 (80,4%) van de 175 patiënten met dwerggroei van beide geslachten een lengte van meer dan 130 cm, 92 (52,5%) meer dan 140 cm en 32 (18,3%) 150-160 cm of meer. Tegelijkertijd namen bij 37 patiënten (21,2%) de lengte toe met 30 cm, bij 107 (61,1%) met 31-50 cm en bij 31 (17,7%) met 51-60 cm of meer.
Prognose
De prognose hangt af van de vorm van dwerggroei. Bij genetische vormen van dwerggroei is de prognose voor het leven gunstig. Bij aanwezigheid van een hypofysetumor en organische schade aan het centrale zenuwstelsel wordt de prognose bepaald door de dynamiek van de ontwikkeling van het belangrijkste pathologische proces. Moderne therapiemethoden hebben de fysieke mogelijkheden en het werkvermogen van patiënten aanzienlijk verbeterd en hun levensverwachting verlengd. Tijdens de actieve behandeling moeten patiënten elke 2-3 maanden door een arts worden onderzocht, bij onderhoudstherapie elke 6-12 maanden.
Het is van groot belang dat patiënten een baan krijgen die past bij hun intellectuele en fysieke mogelijkheden, voor hun sociale aanpassing.
Het is raadzaam om beroepen te kiezen die niet gepaard gaan met zware fysieke inspanning, maar waarmee u wel intellectuele capaciteiten, nauwkeurig werk en talenkennis kunt aantonen.


 [
[